题目内容
14.常温下,下列各组粒子在指定溶液中能量共存的是( )| A. | 能使淀粉-KI试纸显蓝色的溶液中:K+、H+、SO42-、I- | |
| B. | 能溶解CaCO3的溶液中:Fe2+、Ca2+、Cl-、NO3- | |
| C. | 在酸性KMnO4溶液中:Na+、C2H5OH、NH4+、Cl- | |
| D. | 澄清透明的溶液中:Cu2+、Mg2+、SO42-、Cl- |
分析 A.能使淀粉-KI试纸显蓝色的溶液,具有氧化性;
B.能溶解CaCO3的溶液,具有酸性;
C.KMnO4可氧化乙醇;
D.该组离子之间不反应.
解答 解:A.能使淀粉-KI试纸显蓝色的溶液,具有氧化性,不能存在还原性离子I-,故A不选;
B.能溶解CaCO3的溶液,具有酸性,Fe2+、H+、NO3-发生氧化还原反应,不能共存,故B不选;
C.KMnO4可氧化乙醇,不能大量共存,故C不选;
D.该组离子之间不反应,可大量共存,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的判断,题目难度不大.

练习册系列答案
相关题目
5.将AgCl 和AgI 的饱和溶液相混合,在其中加入足量AgNO3 固体,将会( )
| A. | 只有AgCl 沉淀 | B. | 只有AgI 沉淀 | ||
| C. | AgCl、AgI 都沉淀,以AgCl 为主 | D. | AgCl、AgI 都沉淀,以AgI 为主 |
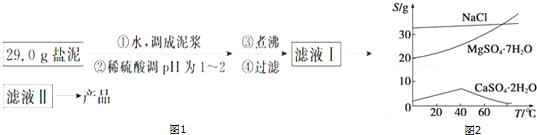
2.蛇纹石矿可以看做由MgO、Fe2O3、Al2O3和SiO2组成.某实验小组设计如下流程欲分别制得单质Mg、Fe、Al和Si.
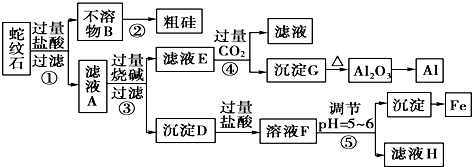
有关氢氧化物沉淀时的pH见如表:
请回答下列问题:
(1)滤液A中含有的阳离子有Fe3+、Al3+、Mg2+、H+;
(2)操作④中生成沉淀G的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)由G反应生成Al2O3的反应方程式2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O;
(4)操作⑤中调节pH=5~6时,可以用到的试剂为c(填字母).
a.NaOH溶液 b.氨水 c.MgO
(5)由滤液H制取金属Mg的流程如下:
滤液H$\stackrel{加热浓缩}{→}$$\stackrel{冷却结晶}{→}$MgCl2•6MgCl2-→Mg
该流程中由MgCl2冶炼Mg的方法是电解.

有关氢氧化物沉淀时的pH见如表:
| 金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Mg2+ | 9.4 | 11.6 |
(1)滤液A中含有的阳离子有Fe3+、Al3+、Mg2+、H+;
(2)操作④中生成沉淀G的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)由G反应生成Al2O3的反应方程式2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O;
(4)操作⑤中调节pH=5~6时,可以用到的试剂为c(填字母).
a.NaOH溶液 b.氨水 c.MgO
(5)由滤液H制取金属Mg的流程如下:
滤液H$\stackrel{加热浓缩}{→}$$\stackrel{冷却结晶}{→}$MgCl2•6MgCl2-→Mg
该流程中由MgCl2冶炼Mg的方法是电解.
6.下列有关实验操作或实验数据的说法正确的是( )
| A. | 用10mL量筒量取7.13mL稀盐酸 | |
| B. | 用托盘天平称量25.20g NaCl | |
| C. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| D. | 可用50.00mL碱式滴定管量取20.00mL氢氧化钾溶液 |
3.下列实验事实能用同一原理解释的是( )
| A. | SO2、Cl2都能使品红溶液褪色 | |
| B. | NH4Cl晶体、固体碘受热时都能气化 | |
| C. | 乙烯通入酸性高锰酸钾溶液和溴水都能使其褪色 | |
| D. | 葡萄糖、乙醛分别与新制Cu(OH)2共热时都能产生红色沉淀 |
4.下列富含糖类的是( )


| A. | ①③④ | B. | ①②④ | C. | ②③④ | D. | ①②③ |