题目内容
9.50mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液在如图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
(1)大小烧杯间填满碎泡沫塑料的作用保温、隔热,减少实验过程中的热量损失.
(2)不能(填“能”或“不能”)将环形玻璃搅拌棒改为环形金属(如铜)棒.其原因是金属导热,导致热量散失.
(3)大烧杯上如不盖硬纸板,对求得中和热数值的影响是偏低(填“偏高”或“偏低”或“无影响”).
(4)如果改用60mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量增加(“增加”、“减少”或“不变”),理由是后者生成0.055molH2O,而前者只能生成0.050molH2O;所求中和热数值不变(“增加”、“减少”或“不变”),理由是中和热是指酸跟碱发生中和反应生成1摩尔H2O时所放出的热量,与酸碱的用量无关.
(5)某研究小组将装置完善后,把V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图2所示(实验中始终保持V1+V2=50mL).回答下列问题:研究小组做该实验时环境温度低于(填“高于”、“低于”或“等于”)22℃.
分析 (1)根据量热计的构造来判断该装置的大小烧杯间填满碎泡沫塑料的作用;
(2)中和热测定实验成败的关键是保温工作;
(3)不盖硬纸板,会有一部分热量散失;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(5)实验时的温度应为酸碱未混合之前的温度.
解答 解:(1)根据量热计的构造和实验的成败关键来判断该装置的大小烧杯间填满碎泡沫塑料的作用是保温、隔热,减少热量散失;
故答案为:保温、隔热,减少实验过程中的热量损失;
(2)中和热测定实验成败的关键是保温工作,金属铜的导热效果好于环形玻璃搅拌棒;
故答案为:不能;金属导热,导致热量散失;
(3)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小;
故答案为:偏低;
(4)反应放出的热量和所用酸以及碱的量的多少有关,50mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液进行反应,生成水的量为0.050mol,改用60mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液进行反应,生成0.055molH2O,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关;
故答案为:增加;后者生成0.055molH2O,而前者只能生成0.050molH2O;不变;中和热是指酸跟碱发生中和反应生成1摩尔H2O时所放出的热量,与酸碱的用量无关;
(5)温度为22℃时加入了5mL氢氧化钠溶液,中和反应为放热反应,则做该实验时环境温度低于22℃;
故答案为:低于.
点评 本题考查了中和热的测定方法、误差分析,题目难度不大,注意掌握测定中和热的正确方法,明确实验操作过程中关键在于尽可能减少热量散失,使测定结果更加准确.

 名校课堂系列答案
名校课堂系列答案| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 水泥、玻璃、青花瓷、水晶、玛瑙、分子筛都属于硅酸盐工业产品 | |
| C. | 氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理 | |
| D. | 通入过量的空气,可以使燃料充分燃烧,同时提高热量的利用率 |
| A. | 纯水的导电性很差,所以水不是电解质 | |
| B. | Na2O液态时能导电,所以Na2O是电解质 | |
| C. | 液态的铜导电性很好,所以铜是电解质 | |
| D. | 溶于水或熔融状态下能导电的化合物 |
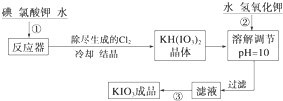
(1)已知步骤①反应器发生的反应中,单质碘和氯酸钾的物质的量之比为6:11,则反应器中发生反应的化学方程式为6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑.
(2)步骤②中调节pH=10的目的是使KH(IO3)2转化为KIO3.
参照碘酸钾的溶解度:
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3 g/100g H2O | 8.08 | 12.6 | 18.3 | 24.8 |
(3)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应,然后用四氯化碳检验生成的碘单质时,甲应观察到的明显现象有液体分层,下层液体呈现紫红色.
学生乙对纯净的NaCl进行了如下实验:取1g纯净的NaCl,加3mL水配成溶液,然后滴入5滴淀粉溶液和1mL 0.1mol•L-1 KI溶液,振荡,溶液无变化,然后再滴入1滴1mol•L-1的H2SO4,振荡,一段时间后溶液变浅蓝色.请推测实验中产生蓝色现象的可能原因,用离子方程式表示4I-+4H++O2═2I2+2H2O.
(4)学生丙查阅有关食品碘强化剂的资料后知道,碘酸钙也是一种允许使用的食品碘强化剂,它是一种白色结晶或结晶性粉末,难溶于水和乙醇.丙同学在氯化钙溶液中加入理论量的碘酸钾溶液,反应生成的沉淀经水洗后,室温下干燥得碘酸钙晶体,加热至160~540℃变成无水物,此时固体质量为原晶体质量的78.3%,写出制备碘酸钙晶体的离子方程式:Ca2++2IO${\;}_{3}^{-}$+6H2O═Ca(IO3)2•6H2O;检验沉淀已经洗涤干净的方法是在最后一次洗涤液中加入硝酸银溶液,若无白色沉淀说明已经洗涤干净.
| A. | C4H10 | B. | C2H4Cl2 | C. | CH2Cl2 | D. | 聚乙烯 |
| A. | c(OH-)>c(H+)的溶液 | |
| B. | 含OH-的溶液 | |
| C. | pH=3的CH3COOH与pH=11的NaOH溶液等体积混合 | |
| D. | 滴加甲基橙后溶液显红色 |
 和
和 的合理试剂是氯化铁溶液.
的合理试剂是氯化铁溶液.
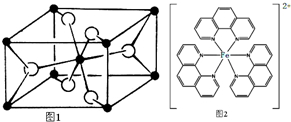
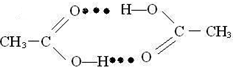 .
.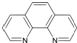 ),它能与Fe2+形成红色配合物(如右图2),
),它能与Fe2+形成红色配合物(如右图2),