题目内容
工业制硫酸的一步重要反应是SO2在400~500℃的催化氧化:2SO2+O2 2SO3,这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下述说法中错误的是
2SO3,这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下述说法中错误的是
A.在上述条件下,SO2不可能100%转化为SO3
B.达到平衡时,SO2、SO3的物质的量浓度相等
C.使用催化剂可以加快反应速率,提高生产效率
D.适当提高O2的浓度,可以提高SO2的转化率
【答案】
B
【解析】
试题分析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,据此可知选项A正确;平衡时物质的浓度不再发生变化,但各种物质的浓度之间不一定是相等的,B不正确;催化剂可以加快反应速率,提高生产效率,C正确;增大氧气的浓度,加快反应速率,D正确,答案选B。
考点:考查可逆反应平衡状态的特点、外界条件对反应速率的影响
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生学生能力的培养和训练,有利于培养学生的逻辑推理能力和抽象思维能力。该题的关键是明确可逆反应平衡状态的形成以及特点,然后灵活运用即可。

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
工业制硫酸的一步重要反应是SO2在400~500℃的催化氧化:2SO2+O2 2SO3,这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下述说法中错误的是
2SO3,这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下述说法中错误的是
| A.在上述条件下,SO2不可能100%转化为SO3 |
| B.达到平衡时,SO2、SO3的物质的量浓度相等 |
| C.使用催化剂可以加快反应速率,提高生产效率 |
| D.适当提高O2的浓度,可以提高SO2的转化率 |
 2SO3,其正反应为放热反应.如果该反应是在密闭容器中进行的,下述有关说法中错误的是( )
2SO3,其正反应为放热反应.如果该反应是在密闭容器中进行的,下述有关说法中错误的是( )
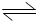 2SO3,其正反应为放热反应.如果该反应是在密闭容器中进行的,下述有关说法中错误的是( )
2SO3,其正反应为放热反应.如果该反应是在密闭容器中进行的,下述有关说法中错误的是( )