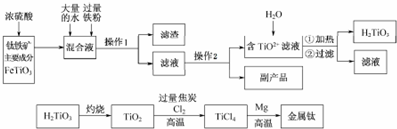
题目内容
4. 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题:(1)曲线由O→a段不产生氢气的原因是硫酸首先和氧化铝反应,不产生H2;有关反应的离子方程式为Al2O3+6H+=2Al3++3H2O;
(2)曲线a→c段,产生氢气的速率增加较快的主要原因反应放热,温度升高是影响反应速率的主要因素,使反应速率增大;
(3)该反应若使用催化剂,能使H2产量增多吗?不能(填“能”或“不能”)
分析 (1)铝是活泼性较强的金属,能迅速和空气中的氧气反应生成氧化铝,根据氧化铝的性质分析;
(2)金属和酸的反应是放热反应,温度升高是影响反应速率的主要因素,根据温度对化学反应速率的影响分析;
(3)催化剂加快反应速率,不影响氢气的产量.
解答 解:(1)铝是活泼性较强的金属,能迅速和空气中的氧气反应生成氧化铝,氧化铝首先稀硫酸反应生成氯化铝和水,不产生H2;
故答案为:硫酸首先与铝片表面的Al2O3反应,不产生H2;
(2)曲线a→c段,金属和酸的反应是放热反应,使溶液的温度升高,温度升高是影响反应速率的主要因素,化学反应速率加快,
故答案为:反应放热,温度升高是影响反应速率的主要因素,使反应速率增大;
(3)催化剂加快反应速率,不影响氢气的产量,
故答案为:不能.
点评 本题考查了化学反应速率的影响因素,难度不大,注意根据图象分析理解随反应进行影响反应速率的主导元素.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目
9.下列说法正确的是( )
| A. | CO2晶体和SiO2晶体中,微粒之间的化学键类型相同,晶体类型也相同 | |
| B. | H2S分子中,所有原子的最外层都达到了8电子的稳定结构 | |
| C. | 碘单质升华过程中不存在化学键被破坏的过程 | |
| D. | NaCl气体溶于水后,因为共价键被破坏,从而形成了Na+和Cl- |
16.下列物质属于纯净物的是( )
| A. | 福尔马林 | B. | 聚乙烯 | C. | 纤维素 | D. | 硬脂酸甘油酯 |
13.下列化合物中,既含有离子键又含有共价键的是( )
| A. | NaNO3 | B. | MgO | C. | C2H6 | D. | CO2 |
14.下列说法不正确的是( )
| A. | 1 mol葡萄糖能水解生成2 mol CH3CH2OH和2 mol CO2 | |
| B. | 医药中常用酒精来消毒,是因为酒精能够使病毒的蛋白质发生变性 | |
| C. | 醋酸和硬脂酸互为同系物,C2H6和C9H20也一定互为同系物 | |
| D. | 丙氨酸和苯丙氨酸脱水缩合,最多可生成4种二肽 |