题目内容
苯乙烯是重要的基础有机化工原料.工业中以乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=CH2)的反应方程式为:C6H5-CH2CH3(g)?C6H5-CH=CH2(g)+H2(g)△H1
(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图1所示:600℃时,由图1可知:

①氢气的物质的量分数为 .
②乙苯的平衡转化率为 .
③计算此温度下该反应的平衡常数 .
(2)分析上述平衡体系组成与温度的关系图可知:
①△H1 0(填“>”、“=”或“<”).
②当温度高于970℃,苯乙烯的产率不再增加,其原因可能是 .
(3)已知某温度下,当压强为101.3kPa时,该反应中乙苯的平衡转化率为30%;在相同温度下,若反应体系中加入稀释剂水蒸气并保持体系总压为101.3kPa,请在图2中画出.
乙苯的平衡转化率与
的关系曲线[
=12时,乙苯的平衡转化率基本保持不变].
(4)已知:3C2H2(g)?C6H6(g)△H2
C6H6(g)+C2H4(g)?C6H5-CH2CH3(g)△H3
则反应3C2H2(g)+C2H4(g)?C6H5-CH=CH2(g)+H2(g)的△H= .
(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图1所示:600℃时,由图1可知:

①氢气的物质的量分数为
②乙苯的平衡转化率为
③计算此温度下该反应的平衡常数
(2)分析上述平衡体系组成与温度的关系图可知:
①△H1
②当温度高于970℃,苯乙烯的产率不再增加,其原因可能是
(3)已知某温度下,当压强为101.3kPa时,该反应中乙苯的平衡转化率为30%;在相同温度下,若反应体系中加入稀释剂水蒸气并保持体系总压为101.3kPa,请在图2中画出.
乙苯的平衡转化率与
| n(水蒸气) |
| n(乙苯) |
| n(水蒸气) |
| n(乙苯) |
(4)已知:3C2H2(g)?C6H6(g)△H2
C6H6(g)+C2H4(g)?C6H5-CH2CH3(g)△H3
则反应3C2H2(g)+C2H4(g)?C6H5-CH=CH2(g)+H2(g)的△H=
考点:产物的百分含量随浓度、时间的变化曲线,用盖斯定律进行有关反应热的计算,化学平衡的影响因素,转化率随温度、压强的变化曲线
专题:基本概念与基本理论
分析:(1)①利用三段式求出平衡时各组分的物质的量,然后应用
×100%解氢气的物质的量分数;
②乙苯的平衡转化率=
×100%;
③根据三行式求出平衡时各组的浓度,最后代入平衡常数表达式;
(2)①由图可知温度升高,氢气平衡的物质量分数在增加,所以平衡正向移动,正反应为吸热反应;
②温度太高时乙苯分解为碳和氢气;
(3)体系总压强不变时,加入稀释剂,参与反应的各物质浓度同等程度减小,相当于反应体系减压,故平衡向气体物质的量增大的方向移动,C6H5C2H5平衡转化率增大;
(4)利用盖斯定律结合已知热化学方程式计算.
| 该物质的物质的量 |
| 平衡混合体系的总量 |
②乙苯的平衡转化率=
| 参加反应的量 |
| 起始的量 |
③根据三行式求出平衡时各组的浓度,最后代入平衡常数表达式;
(2)①由图可知温度升高,氢气平衡的物质量分数在增加,所以平衡正向移动,正反应为吸热反应;
②温度太高时乙苯分解为碳和氢气;
(3)体系总压强不变时,加入稀释剂,参与反应的各物质浓度同等程度减小,相当于反应体系减压,故平衡向气体物质的量增大的方向移动,C6H5C2H5平衡转化率增大;
(4)利用盖斯定律结合已知热化学方程式计算.
解答:
解:(1)①C6H5-CH2CH3(g)?C6H5-CH=CH2(g)+H2(g)
起始量 a mol 0 0
变化量 x mol x mol x mol
平衡量 (a-x)mol x mol x mol
由图1可知,600℃时乙苯的含量为50%,则:
×100%=50%,解得x=
a,
氢气的物质的量分数为
×100%=25%,
故答案为:25%;
②乙苯的平衡转化率为
×100%=33.3%,故答案为:33.3%;
③C6 H5-CH2 CH3 (g)?C6 H5-CH=CH2 (g)+H2(g)
各物质的平衡浓度:c(C6 H5-CH2 CH3 )=
mol?L-1,c(C6 H5-CH=CH2)=
mol?L-1,c(H2)=
mol?L-1,
则K=
=
,
故答案为:
;
(2)①由图可知温度升高氢气平衡的物质量分数在增加,平衡正向移动,正反应为吸热反应,故答案为:>;
②当温度高于970℃时,由于温度太高,剩余的乙苯分解为碳和氢气,所以苯乙烯的产率不再增加;
故答案为:剩余的乙苯脱氢炭化;
(3)(3)体系总压强不变时,加入稀释剂,参与反应的各物质浓度同等程度减小,相当于反应体系减压,故平衡向气体物质的量增大的方向移动,C6H5C2H5平衡转化率增大,起始时乙苯的平衡转化率为30%,当
增大时,乙苯的转化率增大,当[
=12时,乙苯的平衡转化率基本保持不变,据此画图为: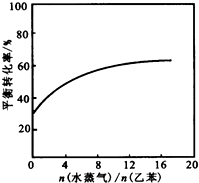 ;
;
故答案为: ;
;
(4)已知:①C6H5-CH2CH3(g)?C6H5-CH=CH2(g)+H2(g)△H1
②3C2H2(g)?C6H6(g)△H2
③C6H6(g)+C2H4(g)?C6H5-CH2CH3(g)△H3
由盖斯定律可知,①式+②式+③式得:3C2H2(g)+C2H4(g)?C6H5-CH=CH2(g)+H2(g)△H=△H1+△H2+△H3,
故答案为:△H1+△H2+△H3.
起始量 a mol 0 0
变化量 x mol x mol x mol
平衡量 (a-x)mol x mol x mol
由图1可知,600℃时乙苯的含量为50%,则:
| a-x |
| a-x+x+x |
| 1 |
| 3 |
氢气的物质的量分数为
| x |
| a-x+x+x |
故答案为:25%;
②乙苯的平衡转化率为
| x mol |
| amol |
③C6 H5-CH2 CH3 (g)?C6 H5-CH=CH2 (g)+H2(g)
各物质的平衡浓度:c(C6 H5-CH2 CH3 )=
| 2a |
| 3V |
| a |
| 3V |
| a |
| 3V |
则K=
| ||||
|
| a |
| 6V |
故答案为:
| a |
| 6V |
(2)①由图可知温度升高氢气平衡的物质量分数在增加,平衡正向移动,正反应为吸热反应,故答案为:>;
②当温度高于970℃时,由于温度太高,剩余的乙苯分解为碳和氢气,所以苯乙烯的产率不再增加;
故答案为:剩余的乙苯脱氢炭化;
(3)(3)体系总压强不变时,加入稀释剂,参与反应的各物质浓度同等程度减小,相当于反应体系减压,故平衡向气体物质的量增大的方向移动,C6H5C2H5平衡转化率增大,起始时乙苯的平衡转化率为30%,当
| n(水蒸气) |
| n(乙苯) |
| n(水蒸气) |
| n(乙苯) |
 ;
;故答案为:
 ;
;(4)已知:①C6H5-CH2CH3(g)?C6H5-CH=CH2(g)+H2(g)△H1
②3C2H2(g)?C6H6(g)△H2
③C6H6(g)+C2H4(g)?C6H5-CH2CH3(g)△H3
由盖斯定律可知,①式+②式+③式得:3C2H2(g)+C2H4(g)?C6H5-CH=CH2(g)+H2(g)△H=△H1+△H2+△H3,
故答案为:△H1+△H2+△H3.
点评:本题考盖斯定律的应用、化学平衡常数的计算、以及三行式来求反应的转化率等,题目计算量较大,涉及的知识点较多,难度中等,注意对图象的分析利用是解题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列叙述不正确的是( )
| A、在CaF2晶体中,与一个Ca2+距离最近且相等的F-的个数是8 |
| B、前三能层完全填充满电子的正一价离子,对应元素在ds区 |
| C、钠晶体的配位数是8 |
D、 钇钡铜氧的晶胞如图所示,则其化学式为YBa2Cu3O8 |
 如图是氯化钠晶体的结构示意图,其中,与每个Na+距离最近且等距离的几个Cl-所围成的空间的构形为( )
如图是氯化钠晶体的结构示意图,其中,与每个Na+距离最近且等距离的几个Cl-所围成的空间的构形为( )| A、正四面体形 | B、正六面体形 |
| C、正八面体形 | D、三角锥形 |
下列表达式中正确的是( )
A、氯化氢分子的电子式: | ||
B、S2-的结构示意图: | ||
C、O-18的原子符号:
| ||
| D、N2分子的结构式:N=N |


 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察下图,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察下图,然后回答问题.
