题目内容
20.下列有关稀有气体的描述不正确的是( )①原子的最外层电子数都有8个 ②其原子与下周期第ⅠA族、ⅡA族的阳离子具有相同的电子层结构③有些稀有气体能跟某些物质反应 ④原子半径比同周期的元素的原子大.
| A. | 只有① | B. | ①和③ | C. | ①和② | D. | ②和④ |
分析 ①氦最外层只有2个电子;
②第ⅠA族、ⅡA族元素失去外层电子,其阳离子比原子少一个电子层,原子的次外层是阳离子最外电子层结构;
③稀有气体中的氙、氪等跟活泼的非金属元素氟反应生成氙和氪的氟化物,如XeF2、XeF4、XeF6等;
④因为稀有气体在测量其原子半径时所用的方法与测量其他族元素的半径方法不同.
解答 解:①氦最外层只有2个电子,故错误;
②第ⅠA族、ⅡA族元素失去外层电子,其阳离子比原子少一个电子层,原子的次外层是阳离子最外电子层结构,所以离子的电子层结构与上一周期惰性元素的原子相同,故正确;
③稀有气体中的氙、氪等跟活泼的非金属元素氟反应生成氙和氪的氟化物,如XeF2、XeF4、XeF6等,故正确;
④因为稀有气体在测量其原子半径时所用的方法与测量其他族元素的半径方法不同,所以除稀有气体外,同周期元素的原子半径依次减小,它是同周期中原子半径最大的,故正确;
故选A.
点评 本题考查元素周期表的结构与应用,为高频考点,把握周期表的结构、元素性质与位置为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
11.已知Ⅰ、Ⅱ反应在一定条件下焓变及平衡常数如下:
2H2(g)+S2(g)?2H2S(g) K1;△H1 (Ⅰ)
3H2(g)+SO2(g)?2H2O(g)+H2S(g) K2;△H2 (Ⅱ)
(1)用△Hl、△H2表示反应4H2(g)+2SO2(g)?S2(g)+4H2O(g)的△H=△H2×2-△H1
(2)回答下列反应(I)的相关问题:
①温度为T1,在1L恒容容器中加入1.8molH2、1.2molS2,10min时反应达到平衡.测得10min内v(H2S)=0.08mol•L-1•min-1,则该条件下的平衡常数为0.8L•mol-1,若此时再向容器中充入H2(g)、S2(g)、H2S(g)各0.8mol,则平衡移动方向为正向(填“正向”、“逆向”或“不移动”);
②温度为T2时T2>T1,在1L恒容容器中也加入1.8molH2(g)、1.2molS2(g),反应建立平衡时测得S2(g)的转化率为25%,据此判断△H1<0(填“>”或“<”),与T1时相比,平衡常数K2减小(填“增大”、“减小”或“不变”).
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等.
①已知Na2SO3水溶液显碱性,原因是SO32-+H2O?HSO3-+OH-(写出主要反应的离子方程式),该溶液中,c(Na+)<2c(SO32-)+c(HSO3-)+c(OH-)(填“>”、“<”或“='’).
②在某NaHSO3、Na2SO3混合溶液中,HSO3-和SO32-物质的量之比与溶液pH变化如下表所示(部分):
根据表中数据,求盐Na2SO3溶液中SO32-的水解平衡常数K(SO32-)=10-6.2mol•L-1.
2H2(g)+S2(g)?2H2S(g) K1;△H1 (Ⅰ)
3H2(g)+SO2(g)?2H2O(g)+H2S(g) K2;△H2 (Ⅱ)
(1)用△Hl、△H2表示反应4H2(g)+2SO2(g)?S2(g)+4H2O(g)的△H=△H2×2-△H1
(2)回答下列反应(I)的相关问题:
①温度为T1,在1L恒容容器中加入1.8molH2、1.2molS2,10min时反应达到平衡.测得10min内v(H2S)=0.08mol•L-1•min-1,则该条件下的平衡常数为0.8L•mol-1,若此时再向容器中充入H2(g)、S2(g)、H2S(g)各0.8mol,则平衡移动方向为正向(填“正向”、“逆向”或“不移动”);
②温度为T2时T2>T1,在1L恒容容器中也加入1.8molH2(g)、1.2molS2(g),反应建立平衡时测得S2(g)的转化率为25%,据此判断△H1<0(填“>”或“<”),与T1时相比,平衡常数K2减小(填“增大”、“减小”或“不变”).
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等.
①已知Na2SO3水溶液显碱性,原因是SO32-+H2O?HSO3-+OH-(写出主要反应的离子方程式),该溶液中,c(Na+)<2c(SO32-)+c(HSO3-)+c(OH-)(填“>”、“<”或“='’).
②在某NaHSO3、Na2SO3混合溶液中,HSO3-和SO32-物质的量之比与溶液pH变化如下表所示(部分):
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
8.Na2O2晶体中含有的化学键有( )
| A. | 离子键、σ键 | B. | 极性键、离子键 | C. | 离子键 | D. | 离子键、π键 |
15.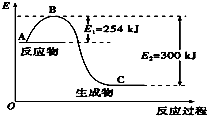 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
(1)如图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,A代表的含义代表反应物的总能量A与C差值代表的含义代表反应热的大小.请写出N2和H2反应的热化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92KJ/mol.反应过程中加入正向催化剂,E1和E2变化情况变小(变大,变小,不变),△H变化情况不变(变大,变小,不变)假设此反应在密闭容器中反应过程中活化分子百分数变化情况变大(变大,变小,不变).
(2)若已知下列数据
试根据表中及图中数据计算N-H的键能为390kJ•mol-1.
(3)用NH3催化还原NOx还可以消除氮氧化物的污染.
例如:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H1=-a kJ•mol-1 ①
N2(g)+O2(g)═2NO(g)△H2=-b kJ•mol-1 ②
若1mol NH3还原NO至N2,并生成水蒸气,则该反应过程中的反应热△H3=$\frac{(3b-a)}{4}$kJ•mol-1(用含a、b的式子表示).
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.(1)如图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,A代表的含义代表反应物的总能量A与C差值代表的含义代表反应热的大小.请写出N2和H2反应的热化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92KJ/mol.反应过程中加入正向催化剂,E1和E2变化情况变小(变大,变小,不变),△H变化情况不变(变大,变小,不变)假设此反应在密闭容器中反应过程中活化分子百分数变化情况变大(变大,变小,不变).
(2)若已知下列数据
| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
(3)用NH3催化还原NOx还可以消除氮氧化物的污染.
例如:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H1=-a kJ•mol-1 ①
N2(g)+O2(g)═2NO(g)△H2=-b kJ•mol-1 ②
若1mol NH3还原NO至N2,并生成水蒸气,则该反应过程中的反应热△H3=$\frac{(3b-a)}{4}$kJ•mol-1(用含a、b的式子表示).
5.下列化学反应中,属于氧化还原反应的是( )
| A. | C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2 | B. | NH3+HCl=NH4Cl | ||
| C. | 2Fe(OH)3$\frac{\underline{\;加热\;}}{\;}$Fe2O3+3H2O | D. | NaOH+HNO3=NaNO3+H2O |
12.元素性质随原子序数的递增呈周期性变化的本质是( )
| A. | 原子核外电子排布呈现周期性变化 | |
| B. | 原子的电子层数增多 | |
| C. | 元素的相对原子质量逐渐增大,量变引起质变 | |
| D. | 原子半径呈周期性变化 |
9.人们在研究金星大气成分时发现金星大气中有一种称为羰基硫(COS)的分子,其结构与CO2类似,羰基硫是一种与生命密切相关的物质,下列有关COS的推测不正确的是( )
| A. | COS分子是含有极性键的极性分子 | |
| B. | COS的电子式为: | |
| C. | COS的分子中所有原子满足8电子稳定结构 | |
| D. | COS分子中三个原子处于同一直线上 |
10.下列有关醛的判断不正确的是( )
| A. | 用溴水检验CH2═CH-CHO中是否含有碳碳双键 | |
| B. | 1mol HCHO发生银镜反应最多生成4mol Ag | |
| C. | 乙醛能使高锰酸钾酸性溶液褪色 | |
| D. | 能发生银镜反应的有机物不一定是醛类 |
 某学生实验小组,用稀硫酸和稀氢氧化钠溶液在如图所示的装置中,进行中和反应反应热的测定.请回答下列问题:
某学生实验小组,用稀硫酸和稀氢氧化钠溶液在如图所示的装置中,进行中和反应反应热的测定.请回答下列问题: