题目内容
元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下面是八种短周期元素的相关信息(已知铍的原子半径为0.089nm)
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色.
(1)B元素在元素周期表中的位置 .B形成的简单离子的结构示意图 .
(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是 (填化学式).
(3)用电子式表示C、H形成化合物的过程: .
(4)H、E形成原子个数比为1:1的化合物中所含化学键类型为 .
(5)F与G形成的最简单的化合物的电子式 ,该分子的结构式为 .
(6)E的氢化物比C的氢化物的熔沸点高的原因是 .
(7)A、B、C、E原子半径由大到小的顺序为 .
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)B元素在元素周期表中的位置
(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是
(3)用电子式表示C、H形成化合物的过程:
(4)H、E形成原子个数比为1:1的化合物中所含化学键类型为
(5)F与G形成的最简单的化合物的电子式
(6)E的氢化物比C的氢化物的熔沸点高的原因是
(7)A、B、C、E原子半径由大到小的顺序为
考点:位置结构性质的相互关系应用
专题:
分析:短周期元素中,F原子中无中子,则F为H元素;G最高正价数与负价数相等,且最外层电子数是次外层的二倍,原子只能有2个电子层,最外层电子数为4,故G为碳元素;H元素单质焰色反应呈黄色,则H为Na;C、E均有-2价,处于ⅣA族,且C的原子半径较大,故C为S元素、E为O元素;D有-1价,原子半径大于O,故D为Cl元素;A有+2价、B有+3价,原子半径均大于S,可推知A为Mg、B为Al,据此解答.
解答:
解:短周期元素中,F原子中无中子,则F为H元素;G最高正价数与负价数相等,且最外层电子数是次外层的二倍,原子只能有2个电子层,最外层电子数为4,故G为碳元素;H元素单质焰色反应呈黄色,则H为Na;C、E均有-2价,处于ⅣA族,且C的原子半径较大,故C为S元素、E为O元素;D有-1价,原子半径大于O,故D为Cl元素;A有+2价、B有+3价,原子半径均大于S,可推知A为Mg、B为Al,
(1)B为Al元素,在元素周期表中的位置为:第三周期ⅢA族,B形成的简单离子的结构示意图为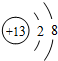 ,故答案为:第三周期ⅢA族;
,故答案为:第三周期ⅢA族;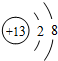 ;
;
(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是:HClO4,故答案为:HClO4;
(3)C、H形成化合物为Na2S,用电子式表示其形成过程: ,
,
故答案为: ;
;
(4)H、E形成原子个数比为1:1的化合物为Na2O2,含有离子键、共价键,故答案为:离子键、共价键;
(5)F与G形成的最简单的化合物为CH4,电子式为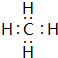 ,该分子的结构式为
,该分子的结构式为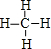 ,
,
故答案为: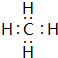 ;
;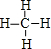 ;
;
(6)H2O分子间存在氢键,H2S分子间不存在氢键,水的沸点高于硫化氢,
故答案为:H2O分子间存在氢键,H2S分子间不存在氢键;
(7)同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:Mg>Al>S>O,故答案为:Mg>Al>S>O.
(1)B为Al元素,在元素周期表中的位置为:第三周期ⅢA族,B形成的简单离子的结构示意图为
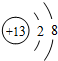 ,故答案为:第三周期ⅢA族;
,故答案为:第三周期ⅢA族;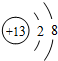 ;
;(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是:HClO4,故答案为:HClO4;
(3)C、H形成化合物为Na2S,用电子式表示其形成过程:
 ,
,故答案为:
 ;
;(4)H、E形成原子个数比为1:1的化合物为Na2O2,含有离子键、共价键,故答案为:离子键、共价键;
(5)F与G形成的最简单的化合物为CH4,电子式为
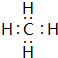 ,该分子的结构式为
,该分子的结构式为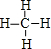 ,
,故答案为:
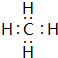 ;
;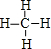 ;
;(6)H2O分子间存在氢键,H2S分子间不存在氢键,水的沸点高于硫化氢,
故答案为:H2O分子间存在氢键,H2S分子间不存在氢键;
(7)同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:Mg>Al>S>O,故答案为:Mg>Al>S>O.
点评:本题考查结构性质位置关系应用,侧重对化学用语的考查,推断元素是解题关键,注意掌握用电子式表示化学键或物质的性质.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
NA代表阿伏伽德罗常数,下列叙述错误的是( )
| A、10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% | ||
B、1L浓度为1mol?L-1的Na2CO3溶液中含有2NA个
| ||
C、1L 2mol?L-1的BaCl2溶液中
| ||
D、一定温度下,1L0.50mol?L-1NaCl溶液与2L 0.25mol?L-1NaCl溶液含
|
用标准盐酸滴定未知浓度的NaOH溶液,如果测得结果偏低,则产生误差的原因可能是下列叙述中的( )
| A、滴定前酸式滴定管尖嘴部分有气泡,滴定终止时气泡消失 |
| B、锥形瓶用蒸馏水洗净后,未经干燥即进行滴定 |
| C、滴定过程中,锥形瓶中有溶液溅出 |
| D、酸式滴定管未用标准盐酸润洗 |
核电站遭破坏会造成放射性物质13153I和13755Cs泄漏.下列说法错误的是( )
| A、每个13755Cs含有82个中子 |
| B、CsOH的碱性比KOH的强 |
| C、HI的还原性比HF的强 |
| D、KIO3是碘的最高价含氧酸的盐 |

 Cu、Zn、稀H2SO4形成如图甲乙装置.
Cu、Zn、稀H2SO4形成如图甲乙装置.