题目内容
下列关于F、Cl、Br、I性质的比较,不正确的是( )
| A、被其他卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大 |
| B、单质的颜色随核电荷数的增加而加深 |
| C、它们的原子核外电子层数随核电荷数的增加而增多 |
| D、它们的氢化物的稳定性随核电荷数的增加而增强 |
考点:卤素原子结构及其性质的比较
专题:元素周期律与元素周期表专题,卤族元素
分析:A、同主族,从上到下,单质的氧化性逐渐减弱;
B、卤素单质的颜色从上到下逐渐加深;
C、同主族,从上到下,元素原子的电子层数依次增多;
D、同主族,从上到下,元素氢化物的稳定性逐渐减弱.
B、卤素单质的颜色从上到下逐渐加深;
C、同主族,从上到下,元素原子的电子层数依次增多;
D、同主族,从上到下,元素氢化物的稳定性逐渐减弱.
解答:
解:A、F、Cl、Br、I的核电核数逐渐增多,单质的氧化性逐渐减弱,被其它卤素单质从其卤化物中置换出来的可能性越来越大,故A正确;
B、F2、Cl2、Br2、I2单质的颜色分别是浅黄绿色、黄绿色、深红棕色和紫黑色,即其颜色逐渐加深,故B正确;
C、F、Cl、Br、I的原子核外电子层数随核电核数的增加而增多,故C正确;
D、按照F、Cl、Br、I的顺序,核电核数逐渐增加,它们的氢化物的稳定性逐渐减弱,故D错误.
故选D.
B、F2、Cl2、Br2、I2单质的颜色分别是浅黄绿色、黄绿色、深红棕色和紫黑色,即其颜色逐渐加深,故B正确;
C、F、Cl、Br、I的原子核外电子层数随核电核数的增加而增多,故C正确;
D、按照F、Cl、Br、I的顺序,核电核数逐渐增加,它们的氢化物的稳定性逐渐减弱,故D错误.
故选D.
点评:本题结合卤族元素考查学生元素周期律的知识,注意把握同主族元素性质的递变规律,题目难度不大.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子晶体,具有良好的超导性.下列有关分析正确的是( )
| A、K3C60中只有离子键 |
| B、K3C60中碳元素显-3价 |
| C、该晶体在熔融状态下能导电 |
| D、C60与12C互为同素异形体 |
 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g);△H<0,现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图.下列说法错误的是( )
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g);△H<0,现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图.下列说法错误的是( )| A、图中共有两条曲线X和Y,其中曲线y表示NO2浓度随时间的变化 |
| B、a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d |
| C、图中在25min时采取的措施是适当缩小容器体积 |
| D、反应进行至25min时,曲线发生变化的原因是加入0.4molNO2 |
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
下列说法正确的是( )
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
A、反应在t1 min内的平均速率为v(H2)=
| ||
| B、保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变 | ||
| C、保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol | ||
| D、温度升高至800℃,上述反应平衡常数为0.64,则正反应为放热反应 |
 为体现“绿色奥运”“科技奥运”,2008年北京奥运会会出现中国自己生产的燃料电池汽车,作为马拉松领跑车和电视拍摄车,预计该车装着“绿色心脏”--质子交换膜燃料电池,其工作原理如图所示,下列叙述正确的是( )
为体现“绿色奥运”“科技奥运”,2008年北京奥运会会出现中国自己生产的燃料电池汽车,作为马拉松领跑车和电视拍摄车,预计该车装着“绿色心脏”--质子交换膜燃料电池,其工作原理如图所示,下列叙述正确的是( )| A、通入氧气的电极发生氧化反应 | ||||
| B、通入氢气的电极为正极 | ||||
C、总反应式为O2+2H2
| ||||
| D、正极的电极反应式为O2+4H+-4e-═2H2O |
下列物质的溶液能导电,但不属于电解质的是( )
| A、Ba(OH)2 |
| B、蔗糖 |
| C、Cl2 |
| D、HCl |
实验室制氯气的反应为:MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑下列说法错误的是( )
| ||
| A、还原剂是HCl,氧化剂是MnO2 |
| B、每生成1molCl2,转移电子的物质的量为2mol |
| C、每消耗1molMnO2,起还原剂作用的HCl消耗4mol |
| D、生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质 |
RO3n-共有x个核外电子,R的质量数为A,R的中子数是( )
| A、A-x+n+24 |
| B、A-x+n+48 |
| C、A-x-n-24 |
| D、A+x-n-24 |
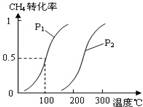 甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇.
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇.