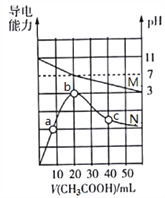
题目内容
【题目】化学实验是进行化学研究的有效方法,请回答下列实验中的有关问题。
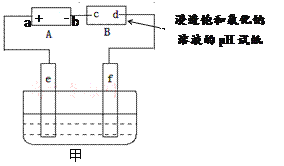
I.用如图所示的装置测定中和热。

实验药品:100mL 0.50 molL-1盐酸、100mL 0.55 molL-1NaOH溶液。
实验步骤:略。
回答下列问题:
(1)从实验装置上看,还缺少环形玻璃搅拌棒,该装置的作用是____________;有同学提议可以用铜质搅拌棒替代,你是否赞同(说明理由)________________。
(2)你认为该实验成功的关键是______________________________。
II.影响化学反应速率的因素很多,某校课外兴趣小组用实验的方法进行探究。甲、乙两个兴趣小组利用Mg、Fe、Cu和不同浓度的硫酸(0.5 molL-1、2 molL-1、18.4 molL-1),设计实验方案来研究影响反应速率的因素。
(1)请帮助甲小组完成研究的实验报告:
实 验 步 骤 | 现 象 | 结 论 |
①分别取等体积0.5 molL-1硫酸于试管中 ②分别投入大小、形状相同的Mg、Fe、Cu ③观察金属表面产生气体的快慢 | ①产生气体的速率Mg>Fe ②Cu上无气体产生 | _________ |
根据控制变量法,要得出正确的实验结论,在实验过程中需要保持温度和压强相同。
(2)乙小组为了更精确地研究浓度对反应速率的影响,利用右图装置进行定量实验。该小组选用的实验药品是:Fe、2molL-1硫酸和______molL-1硫酸。
【答案】 搅拌(将溶液混合均匀) 不赞同,铜质搅拌棒易散热,使实验误差增大 减少中和热的损失 金属性越强的金属单质与稀硫酸反应的速率越快(合理答案可给分) 0.5
【解析】本题主要考查测定中和热和研究影响反应速率的因素的实验方法。
I. (1)从实验装置上看,还缺少环形玻璃搅拌棒,该装置的作用是搅拌(将溶液混合均匀);有同学提议可以用铜质搅拌棒替代,你是否赞同(说明理由):不赞同,铜质搅拌棒易散热,使实验误差增大。
(2)该实验成功的关键是:减少热量的损失。
II. (1)结论:金属性越强的金属单质与稀硫酸反应的速率越快(合理答案可给分)。
(2)该小组选用的实验药品是:Fe、2molL-1硫酸和0.5molL-1硫酸。铁在浓硫酸中被钝化,所以不可选用浓硫酸。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案【题目】氮氧化物是造成酸雨、臭氧空洞、光化学烟雾等环境问题的主要原因之一。如何消除大气污染物中氮氧化物已成为人们关注的主要问题之一。
I.NH3-SCR法是工业上消除氮氧化物的常用方法。该法是利用氨的还原性,在一定条件下,将烟气中的NOx直接还原为N2。
主要反应原理为:4NH3+4NO+O2![]() 4N2+6H2O
4N2+6H2O
(1)已知有下列热化学方程式:
①4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(1) △H =-1891.5kJmol-1
4N2(g)+6H2O(1) △H =-1891.5kJmol-1
②N2(g)+O2(g)![]() 2NO(g) △H =+180.5kJmol-1
2NO(g) △H =+180.5kJmol-1
③H2O(1)=H2O(g) △H =+44.0kJmol-1
则氨气与氧气反应生成NO和气态水的热化学方程式为_________________________________。
(2)其他条件相同,某2 L密闭容器中分别投入2 mol NH3、2 mol NO、1 mol O2,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图所示。
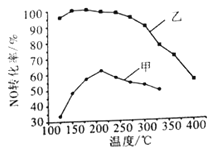
①工业上选择催化剂乙的原因是_________________。
②在催化剂甲作用下,高于210℃时,NO转化率降低的原因可能是_______________________。
Ⅱ.CH4可以消除氮氧化物的污染。主要反应原理为:CH4(g)+2NO2(g)= CO2(g)+2H2O(g)+ N2(g) △H=-868.7kJmol-1
(3)在3.00L密闭容器中,通入0.100mol CH4和0.200mol NO2,在一定温度下进行上述反应,反应时间(t)与容器内气体总压强(P) 的数据见下表:
反应时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
总压强P/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
由表中数据,计算0-4min内v(NO2)=____________,该温度下的平衡常数K=________________。
(4)在一恒容装置中,通入一定量CH4和NO2,测得在相同时间内和不同温度下,NO2的转化率α(NO2)如下图,则下列叙述正确的是_____________
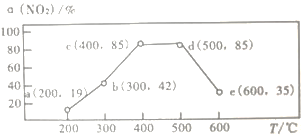
A.若温度维持在200℃更长时间,NO2的转化率将大于19%
B.反应速率:b点的v(逆)>e点的v(逆)
C.平衡常数: c点=d点
D.在时间t内,提高c点时NO2的转化率和反应速率,可适当升温或增大c(CH4)
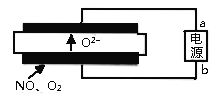
Ⅲ.工业上也常采用电解的方法消除氮氧化物的污染。
(5)清华大学曹天宇等人研究的基于固体氧化物电解池(SOEC)
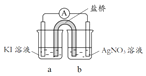
【题目】某小组设计不同实验方案比较Cu2+、Ag+ 的氧化性。
(1)方案1:通过置换反应比较
向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝。反应的离子方程式是_______,说明氧化性Ag+>Cu2+。
(2)方案2:通过Cu2+、Ag+ 分别与同一物质反应进行比较
实验 | 试剂 | 编号及现象 | |
试管 | 滴管 | ||
| 1.0 mol/L KI溶液 | 1.0 mol/L AgNO3溶液 | Ⅰ.产生黄色沉淀,溶液无色 |
1.0 mol/L CuSO4溶液 | Ⅱ.产生白色沉淀A,溶液变黄 | ||
① 经检验,Ⅰ中溶液不含I2,黄色沉淀是________。
② 经检验,Ⅱ中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认A的实验如下:
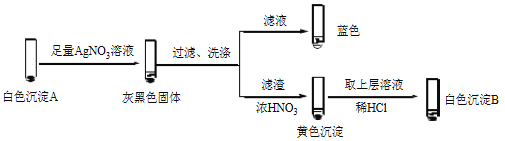
a.检验滤液无I2。溶液呈蓝色说明溶液含有________(填离子符号)。
b.白色沉淀B是________。
c.白色沉淀A与AgNO3溶液反应的离子方程式是____,说明氧化性Ag+>Cu2+。
(3)分析方案2中Ag+ 未能氧化I- ,但Cu2+氧化了I-的原因,设计实验如下:
编号 | 实验1 | 实验2 | 实验3 |
实验 |
|
|
|
现象 | 无明显变化 | a中溶液较快变棕黄色,b中电极 上析出银;电流计指针偏转 | c中溶液较慢变浅黄色; 电流计指针偏转 |
(电极均为石墨,溶液浓度均为 1 mol/L,b、d中溶液pH≈4)
① a中溶液呈棕黄色的原因是_______(用电极反应式表示)。
② “实验3”不能说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是_______。
③ 方案2中,Cu2+能氧化I-,而Ag+未能氧化I-的原因:_______。
(资料:Ag+ + I- = AgI↓ K1 =1.2×1016;2Ag+ + 2I- = 2Ag↓+ I2 K2 = 8.7×108)