题目内容
12.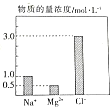 在0.2L由NaCl溶液、MgCl2溶液、CuCl2溶液组成的混合溶液中,部分离子的浓度如图所示.
在0.2L由NaCl溶液、MgCl2溶液、CuCl2溶液组成的混合溶液中,部分离子的浓度如图所示.(1)混合液中,NaCl的物质的量为1mol,MgCl2的质量为9.5g.
(2)该混合溶液中CuCl2的物质的量浓度为0.5mol•L-1,将该混合溶液加水稀释至体积为1L,稀释后溶液中Cu2+的物质的量浓度为0.1mol•L-1.
(3)往混合溶液中加入足量的NaOH溶液,产生的沉淀的质量为9.8g.
分析 (1)由图可知,c(NaCl)=c(Na+)=1mol/L,c(MgCl2)=c(Mg2+)=0.5mol/L,根据n=cV计算NaCl、MgCl2的物质的量,再根据m=nM计算MgCl2的质量;
(2)根据电荷守恒:c(Na+)+2c(Mg2+)+2c(Cu2+)=c(Cl-)计算Cu2+的物质的量浓度,溶液中c(CuCl2)=c(Cu2+),根据稀释定律计算稀释后溶液中Cu2+的物质的量浓度;
(3)根据n=cV计算CuCl2的物质的量,生成沉淀为Cu(OH)2,且n[Cu(OH)2]=n(CuCl2),再根据m=nM计算Cu(OH)2的质量.
解答 解:(1)由图可知,c(NaCl)=c(Na+)=1mol/L,c(MgCl2)=c(Mg2+)=0.5mol/L,NaCl的物质的量为0.2L×1mol/L=0.2mol,MgCl2的物质的量=0.2L×0.5mol/L=0.1mol,MgCl2的质量=0.1mol×95g/mol=9.5g,
故答案为:1;9.5;
(2)根据电荷守恒:c(Na+)+2c(Mg2+)+2c(Cu2+)=c(Cl-),则1mol/L+2×0.5mol/L+2c(Cu2+)=3mol/L,解得c(Cu2+)=0.5mol/L,故溶液中c(CuCl2)=c(Cu2+)=0.5mol/L,根据稀释定律,稀释后溶液中Cu2+的物质的量浓度为$\frac{0.2L×0.5mol/L}{1L}$=0.1mol/L,
故答案为:0.5;0.1;
(3)生成沉淀为Cu(OH)2,n[Cu(OH)2]=n(CuCl2)=0.2L×0.5mol/L=0.1mol,故Cu(OH)2的质量为0.1mol×98g/mol=9.8g,
故答案为:9.8.
点评 本题考查物质的量浓度有关计算,关键是根据电荷守恒计算溶液中Cu2+的浓度,注意大于公式的理解与灵活应用.

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案| A. | 温度计的水银球应插入烧瓶的自来水中 | |
| B. | 冷凝管中的水流方向是从下口进入,上口排出 | |
| C. | 实验中需要在烧瓶中加入几粒碎瓷片,防止出现暴沸现象 | |
| D. | 烧瓶必须垫加石棉网加热 |
| A. | 15 g甲基(-CH3)所含有的电子数是NA | |
| B. | 0.5 mol 1,3-丁二烯分子中含有C═C键数为NA | |
| C. | 标准状况下,1 L戊烷充分燃烧后生成的气态产物的分子数为$\frac{5}{22.4}$NA | |
| D. | 常温常压下,1 mol丙烷所含有的共价键数目为12NA |
| A. | Fe3+、H+、F-、OH- | B. | Fe3+、K+、NO3-、SCN- | ||
| C. | Fe2+、K+、Br-、Cl- | D. | K+、Fe2+、MnO4-、SO42- |
| 碱 | A | B | C |
| 化学式(X、Y为未知元素) | XOH | KOH | Y(OH)2 |
| 摩尔质量之比 | A:C=20:37 | ||
(1)45.28g混合碱所含A、C的质量分别为14.8g、14.8g.
(2)A与C的摩尔质量分别是40g/mol、74g/mol.
| A. | 甲学生:在醋酸钠溶液中滴入酚酞试液,加热(不考虑水蒸发)后若红色加深,说明醋酸钠水解是吸热的 | |
| B. | 乙学生:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的 | |
| C. | 丙学生:取一定浓度的FeCl3溶液置于冰水中一段时间,发现溶液棕黄色变浅,说明FeCl3的水解是吸热的 | |
| D. | 丁学生:实验测定同浓度的热的纯碱液比冷的纯碱液pH高,说明碳酸钠水解是吸热的 |
| A. | CO2的水溶液:c(H+)>c(HCO3-)>2c(CO32-) | |
| B. | 等浓度的HCN溶液与Na0H溶液等体积混合,所得溶液pH>7,则溶液中离子浓度:c(Na+)>c(CN-)>c(OH-)>c(H+) | |
| C. | 0.4mol•L-1某一元酸HA溶液和0.2mol•L-1Na0H溶液等体积混合的溶液中:2c(OH-)+c(A-)=2c(H+)+c(HA) | |
| D. | 两种弱酸HX和HY混合后,溶液中的c(H+)为(Ka为电离平衡常数):c(H+)=$\frac{{K}_{a}(HX)•c(HX)}{c({X}^{-})}$+$\frac{{K}_{a}(HY)•c(HY)}{c({Y}^{-})}$+c(OH-) |
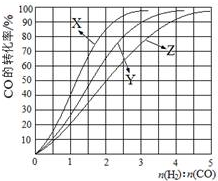
(1)经研究发现在230℃~270℃时合成最为有利.为探寻合成气最合适的起始组成比,分别在230℃、250℃和270℃时进行实验,实验结果如图.230℃的实验结果所对应的曲线是X(填字母); 从提高CO转化率的角度等综合分析,该温度下工业生产适宜采用的合成气组成n(H2):n(CO)的比值范围是B(填字母).
A.1~1.5 B.2.5~3C.3.5~4.5
(2)制甲醇所需要的氢气,可通过下列反应制取:H2O(g)+CO(g)?H2(g)+CO2(g),△H<0,某温度下该反应的平衡常数K=1.回答下列问题:
①该温度下,若起始时c(CO)=2mol•L-1,c(H2O)=3mol•L-1,反应进行一段时间后,测得CO的浓度为1mol•L-1,则此时该反应v(正)>v(逆)(填“>”、“<”或“=”).
②若降低温度,该反应的K值将增大(填“增大”、“减小”或“不变”).
(3)甲醇是一种化工原料,工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1.
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
②变化的热量数值Q中,Q1 与Q2的和是90.8(填具体数值).
(4)目前,以甲醇为原料的燃料电池已经应用于工业生产.如图是甲醇燃料电池应用的示意图,已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O,
 ,
,请根据上图填写下列空白:
乙池中A电极的电极反应式为Ag++e-=Ag,甲池中通入CH3OH电极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.