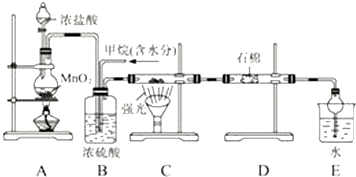
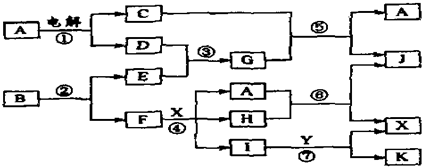
题目内容
8.在气相中,关于BeF2和SF2的说法错误的是( )| A. | BeF2分子中,中心原子Be的价层电子对数等于2,其空间排布为直线,成键电子对数也等于2 | |
| B. | BeF2分子的立体结构为直线形 | |
| C. | SF2分子中,中心原子S的价层电子对数等于4,其空间排布为四面体,成键电子对数等于2,没有孤对电子 | |
| D. | 在气相中,BeF2是直线形而SF2是V形 |
分析 根据价电子对互斥理论,价层电子对个数=σ键个数+孤电子对个数.
价层电子对个数为4,不含孤电子对,为正四面体结构;含有一个孤电子对,空间构型为三角锥形,含有两个孤电子对,空间构型是V型;
价层电子对个数为3,不含孤电子对,平面形结构;含有一个孤电子对,空间构型为为V形结构;
价层电子对个数是2且不含孤电子对,为直线形结构,据此判断.
解答 解:A.B.BeF2分子中,铍原子含有两个共价单键,不含孤电子对,所以价层电子对数是2,中心原子以sp杂化轨道成键,价层电子对个数是2且不含孤电子对,为直线形结构,故AB正确;
C.SF2分子中心原子的价层电子对数目是2+$\frac{6-2×1}{2}$=4,有2个孤电子对,所以S是sp3d杂化,价层电子对个数为4,含有两个孤电子对,空间构型是V型,故C错误;
D.综上法分析,在气相中,BeF2是直线形而SF2是V形,故D正确;
故选C.
点评 本题考查了分子的立体构型的判断,侧重分子结构与性质的考查,原子杂化类型的判断是高考的热点,所以是学习的重点,注意杂化轨道理论的理解应用,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列化学反应的离子方程式正确的是( )
| A. | 氯气与氢氧化钠溶液:Cl2+2OH-=Cl-+ClO-+H2O | |
| B. | 将少量金属钠放人冷水中:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+=SO2↑+H2O | |
| D. | 向澄清石灰水中通入过量二氧化碳:CO2+Ca2++2OH-=CaCO3↓+H2O |
3.以下性质的比较中,正确的是( )
| A. | 晶格能大小:NaI>NaBr>NaCl>NaF | B. | 单质的熔点:Li<Na<K<Rb | ||
| C. | 共价键的键能:C-C>C-Si>Si-Si | D. | 沸点高低:HF<HCl<HBr<HI |
18.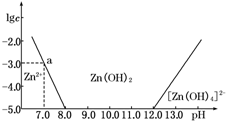 如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.回答下列问题:
如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.回答下列问题:
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为Zn2++4OH-═[Zn(OH)4]2-.
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=10-17.
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是8.0<pH<12.0.
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表:
根据上表数据判断下列说法正确的是A、B、C、D.
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50mol/L盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水.
 如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.回答下列问题:
如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.回答下列问题:(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为Zn2++4OH-═[Zn(OH)4]2-.
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=10-17.
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是8.0<pH<12.0.
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表:
| c(HCl) | |||||||
| (mol/L) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| 103 c(PbCl2) | |||||||
| (mol/L) | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50mol/L盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水.
 有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数.R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2:1.请回答下列问题:
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数.R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2:1.请回答下列问题: