题目内容
9.根据下面的描述,按照要求回答下列问题(1)画出H2O2的电子式:
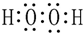
(2)请画出HClO的电子式:
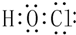
(3)用电子式表示出离子化合物MgCl2的形成过程
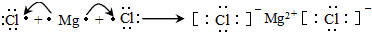
(4)在短周期元素中,由三种非金属元素组成的既有离子键又有共价键,且阴阳离子含电子总数相等的物质,其化学式是NH4F,画出电子式
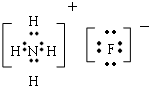
(5)某学生在一次探究“制取氢气最适宜的金属”的实验时,测得镁在与稀硫酸反应,10s末硫酸的浓度减少了0.6mol•L-1,若不考虑反应过程中溶液体积的变化,则10s内生成硫酸镁的平均反应速率是0.06mol•L-1s-1.
分析 (1)过氧化氢中H原子和O原子之间存在极性键、O原子和O原子之间存在非极性键;
(2)次氯酸分子中O原子和H原子、Cl原子之间都存在一对共用电子对;
(3)MgCl2属于离子化合物,Mg最外层两个电子被两个Cl原子得到;
(4)由三种非金属元素形成的离子化合物,且含有共价键,应为铵盐,阴阳离子含电子总数相等,应为氟化铵,据此解答即可;
(5)根据v=$\frac{△c}{△t}$计算v(H2SO4),发生反应:Mg+H2SO4=MgSO4+H2↑,利用速率之比等于化学计量数之比计算v(MgSO4).
解答 解:过氧化氢中H原子和O原子之间存在极性键、O原子和O原子之间存在非极性键,过氧化氢的电子式为 ,故答案为:
,故答案为: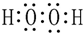 ;
;
(2)次氯酸分子中O原子和H原子、Cl原子之间都存在一对共用电子对,HClO的电子式为: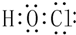 ,故答案为:
,故答案为: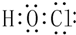 ;
;
(3)MgCl2属于离子化合物,Mg最外层两个电子被两个Cl原子得到,用电子式表示形成过程为: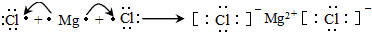 ,故答案为:
,故答案为: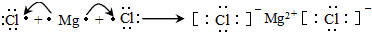 ;
;
(4)由三种非金属元素形成的离子化合物,且含有共价键,应为铵盐,阴阳离子含电子总数相等,应为氟化铵,化学式为:NH4F,电子式为: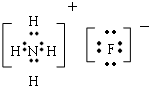 ,故答案为:NH4F;
,故答案为:NH4F;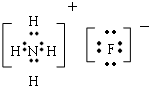 ;
;
(5)10s末硫酸的浓度减少了0.6mol•L-1,则v(H2SO4)=$\frac{0.6mol/L}{10s}$=0.06mol/(L.s),
发生反应:Mg+H2SO4=MgSO4+H2↑,速率之比等于化学计量数之比,故v(MgSO4)=v(H2SO4)=0.06mol/(L.s),故答案为:0.06.
点评 本题主要考查的是电子式的书写、用电子式表示离子化合物的形成过程、化学反应速率的计算等,难度不大.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
1.向BaCl2溶液中通入某混合气体,无沉淀产生,则该混合气体是( )
| A. | 2molNO和1molCO2 | B. | 1molCO2和2molNH3 | ||
| C. | 1molCl2和lmolSO2 | D. | 1molNO2和lmolSO2 |
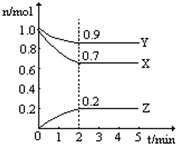 某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析: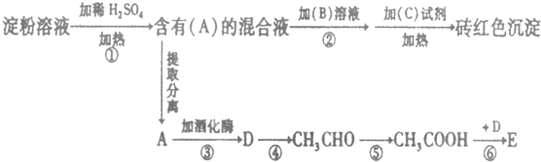
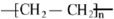 .
. 二氯化一氯五氨合钴([Co(NH3)5Cl]Cl2,M=250.5g•mol-1,紫红色固体)因在离子鉴定、电镀、医学方面的广泛应用受到了人们的关注,它不溶于乙醇,难溶于水.实验室制备二氯化一氯五氨合钴的流程如下,装置如图:
二氯化一氯五氨合钴([Co(NH3)5Cl]Cl2,M=250.5g•mol-1,紫红色固体)因在离子鉴定、电镀、医学方面的广泛应用受到了人们的关注,它不溶于乙醇,难溶于水.实验室制备二氯化一氯五氨合钴的流程如下,装置如图:
 ;
;
 ;元素⑦的原子结构示意图
;元素⑦的原子结构示意图 .
.