题目内容
某烷烃A与炔烃B的混合气体1mol的质量为25.6g,取标准状况下的此混合气体6.72L通入足量的溴水中,结果溴水质量增加4.8g,通过计算推导A、B的分子式及体积比 .
考点:有关混合物反应的计算
专题:计算题
分析:1molA和B的质量为25.6g,则混合气体的平均摩尔质量为25.6g/mol,由于烯烃的相对分子质量最小为28(C2H4),小于25.6的一定为烷烃,该烷烃一定为CH4;
取6.72L标准状况下的此混合气体通入足量溴水中,结果溴水质量增加4.8g,4.8g为炔烃的质量,根据平均摩尔质量计算出混合气体的质量,然后计算出甲烷的质量、物质的量,从而得出炔烃的物质的量,然后计算出炔烃的摩尔质量,写出B的分子式,最后计算出体积之比.
取6.72L标准状况下的此混合气体通入足量溴水中,结果溴水质量增加4.8g,4.8g为炔烃的质量,根据平均摩尔质量计算出混合气体的质量,然后计算出甲烷的质量、物质的量,从而得出炔烃的物质的量,然后计算出炔烃的摩尔质量,写出B的分子式,最后计算出体积之比.
解答:
解:某烷烃A和炔烃B的混合气体物质的量为1mol,质量为25.6g,则混合气体的平均摩尔质量为:
=25.6g/mol,
炔烃中,相对分子量最小的为乙炔,其相对分子量为26,所以混合烃中一定含有甲烷,
标况下6.72L混合气体的物质的量为:
=0.3mol,0.3mol混合气体的质量为:25.6g/mol×0.3g=7.68g,
取6.72L标准状况下的此混合气体通入足量溴水中,结果溴水质量增加4.8,溴水增加的质量为炔烃的质量,
则甲烷的质量为:7.68g-4.8g=2.88g,
混合气体中甲烷的物质的量为:
=0.18mol,
则炔烃的物质的量为:0.3mol-0.18mol=0.12mol,
炔烃的摩尔质量为:
=40g/mol,炔烃的相对分子量为40,设炔烃分子式为CnH2n-2,则14n-2=40,n=3,
该炔烃为丙炔,其分子式为:C3H4;
相同条件下气体体积之比等于物质的量之比,则甲烷与丙炔的体积之比为:0.18mol:0.12mol=3:2,
故答案为:CH4、C3H4,3:2.
| 25.6g |
| 1mol |
炔烃中,相对分子量最小的为乙炔,其相对分子量为26,所以混合烃中一定含有甲烷,
标况下6.72L混合气体的物质的量为:
| 6.72L |
| 22.4L/mol |
取6.72L标准状况下的此混合气体通入足量溴水中,结果溴水质量增加4.8,溴水增加的质量为炔烃的质量,
则甲烷的质量为:7.68g-4.8g=2.88g,
混合气体中甲烷的物质的量为:
| 2.88g |
| 16g/mol |
则炔烃的物质的量为:0.3mol-0.18mol=0.12mol,
炔烃的摩尔质量为:
| 4.8g |
| 0.12mol |
该炔烃为丙炔,其分子式为:C3H4;
相同条件下气体体积之比等于物质的量之比,则甲烷与丙炔的体积之比为:0.18mol:0.12mol=3:2,
故答案为:CH4、C3H4,3:2.
点评:本题考查了有机物分子式的计算、有机物命名等知识,题目难度中等,注意掌握确定有机物分子式、结构简式的方法,明确有机物命名原则,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
两种气态烃的混合气体10mL在50mL氧气里充分燃烧,生成液态水和体积为40mL的气体(气体体积均在同温同压下测定),则这两种烃不可能是( )
| A、C2H2和C2H6 |
| B、C2H2和C3H8 |
| C、CH4和C2H4 |
| D、C2H2和C2H4 |
有氧化铁和氧化铜的混合物a g,加入2mol/L的硫酸溶液50mL时,恰好完全溶解.若将2ag这种混合物在氢气流中加热并充分反应,冷却后剩余固体的质量为( )
| A、0.8g |
| B、1.6ag |
| C、(2a-3.2)g |
| D、(2a-1.6)g |
将31.2g的KOH和KHCO3的混合物在密闭容器内加热到250℃,排气冷却后,测得混合物的质量减少了3.85g.若原混合物中KOH和KHCO3的物质的量分别为amol和bmol,则a与b的关系为( )
| A、a<b | B、a=b |
| C、a>b | D、无法确定 |
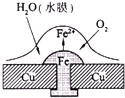 已知铅蓄电池的总反应PbO2+Pb+2H2SO4═2PbSO4+2H2O,图为铁铆钉铆在铜板上,有关叙述不正确的是( )
已知铅蓄电池的总反应PbO2+Pb+2H2SO4═2PbSO4+2H2O,图为铁铆钉铆在铜板上,有关叙述不正确的是( )| A、如图,铁铆钉发生吸氧腐蚀,在铁钉附近滴加K3[Fe(CN)6]溶液,可观察铁钉附近有蓝色沉淀产生 |
| B、铅蓄电池充电时,阳极电极反应为PbSO4+2H2O-2e-=PbO2+4H++SO42- |
| C、铅蓄电池放电时,电路中每转移2mol电子,消耗1mol硫酸 |
| D、铅蓄电池放电时,内电路硫酸根离子向铅极移动,正极附近溶液的pH增大 |
 已知粗盐中含有泥沙,硫酸钠、氯化钙杂质,在进行提纯的过程中,某学生设计了如图所示的实验操作.回答下列问题:
已知粗盐中含有泥沙,硫酸钠、氯化钙杂质,在进行提纯的过程中,某学生设计了如图所示的实验操作.回答下列问题: