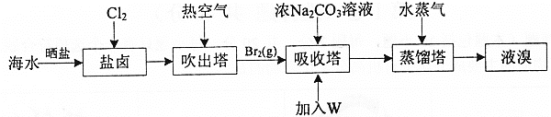
题目内容
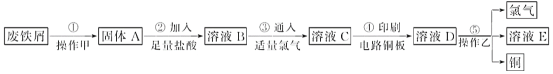
【题目】某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下:
请回答下列问题:
(1)若溶液B中只含有Fe2+而不含Fe3+,可证明该事实的实验方法是________(填序号)。
A.先加氯水,后加KSCN溶液后显红色
B.先加KSCN溶液,不显红色,再加氯水后显红色
C.④只滴加KSCN溶液不显红色
(2)步骤④的化学方程式为_____________________________。
(3)若除去氯化亚铁中氯化铁可以加入试剂________________。
【答案】B 2FeCl3+Cu===2FeCl2+CuCl2 铁
【解析】
(1)亚铁离子具有还原性,铁离子具有氧化性,铁离子能够与硫氰化钾反应生成血红色溶液,据此进行分析;
(2)印刷电路板与FeCl3反应,化合价升高元素是铜,化合价降低的元素是三价铁;
(3)利用铁的还原性、铁离子氧化性进行解答。
(1) A.先加氯水,后加KSCN溶液后显红色无法排除Fe3+的存在,故A不选;
B.先加KSCN溶液,不显红色,再加氯水后显红色即可证明溶液中只含Fe2+不含Fe3+,故B可选;
C.④只滴加KSCN溶液不显红色,只能排除Fe3+的存在,不能证明溶液含Fe2+,故C不选;
故答案选B;
(2)印刷电路板是由高分子材料和铜箔复合而成,FeCl3具有氧化性,和Cu反应生成氯化亚铁和氯化铜,化学方程式为:2FeCl3+Cu===2FeCl2+CuCl2;
故答案是:2FeCl3+Cu===2FeCl2+CuCl2;
(3)铁具有还原性,铁离子具有氧化性,能够和铁反应生成亚铁离子,不引入新杂质,而铁与氯化亚铁不反应,所以除去氯化亚铁中氯化铁可以加入试剂是铁粉;
故答案是:铁粉。

【题目】有X、Y、Z、M、R五种短周期主族元素,部分信息如下表所示:
X | Y | Z | M | R | |
原子半径/nm | 0.074 | 0.099 | |||
主要化合价 | +4,-4 | -2 | -1,+7 | ||
其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 第三周期简单离子半径最小 |
请回答下列问题:
(1)Z与NaOH溶液反应的离子方程式:___。(用元素符号表示,下同。)
(2)下列事实能说明R非金属性比Y强这一结论的是___(选填字母序号)。
a.常温下Y的单质呈固态,R的单质呈气态
b.气态氢化物稳定性R>Y
c.Y与R形成的化合物中Y呈正价
d.Y与R各自形成的含氧酸中R的氧化性更强
(3)经测定X2M2为二元弱酸,写出X2M2的电子式___。其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式___。
(4)已知I2能做X2M2分解的催化剂:
第一步:X2M2+I2=2XIM;
第二步:……
请写出第二步反应的化学方程式___。
(5)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现在改用X2M2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式___。