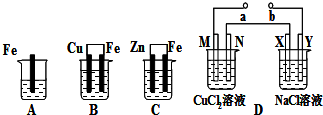
题目内容
9.下列叙述中正确的是( )| A. | 干燥的NaCl晶体不能导电,但NaCl是电解质 | |
| B. | 食盐水能导电,所以食盐水是电解质 | |
| C. | 三氧化硫溶于水能导电,所以三氧化硫是电解质 | |
| D. | 一种物质如果不是电解质,那么它一定是非电解质 |
分析 A.电解质在水溶液或熔融状态下能导电;
B.食盐水是混合物,电解质是化合物;
C、三氧化硫的水溶液导电不是三氧化硫本身导电;
D、电解质是化合物的范畴,有的物质不是电解质也不是非电解质.
解答 解:A.固态氯化钠不导电,但在水溶液或熔融状态下能导电,属于电解质,故A正确;
B.食盐水是混合物,不是化合物,不属于电解质,故B错误;
C.三氧化硫溶于水能导电,三氧化硫是非电解质,故C错误;
D、电解质是化合物的范畴,有的物质不是电解质也不是非电解质,如单质和混合物,故D错误.
故选A.
点评 本题考查电解质、非电解质的定义、物质导电的原因,题目难度不大,注意能导电的不一定是电解质,如硝酸钾溶液;电解质不一定能导电,如固态氯化钾.

练习册系列答案
相关题目
19.关于如图所示装置的叙述中正确的是( )
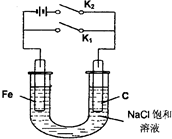

| A. | 若仅闭合K2,铁极的电极反应式:Fe-2e=Fe2+ | |
| B. | 若仅闭合K2,炭极上发生还原反应 | |
| C. | 若仅闭合K1,电子由炭极沿导线流向铁极 | |
| D. | 若仅闭合K1,炭极的电极反应式:2H2O+O2+4e=4OH- |
20.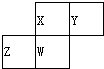 如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
 如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 气态氢化物的稳定性:Z>W>X>Y | |
| C. | W的最高正化合价与负化合价的绝对值不可能相等 | |
| D. | Z的最高价氧化物的水化物可能为强碱 |
4.只用下列试剂中的一种就能鉴别AgNO3、Na2CO3、K2SO4三种溶液,则该试剂是( )
| A. | KNO3溶液 | B. | Na2SO4溶液 | C. | NaOH溶液 | D. | 稀HCl |
1.下列解释事实的方程式正确的是( )
| A. | 将NO2通入水中,红棕色消失:3NO2+H2O═2HNO3+O2 | |
| B. | 向含有Hg2+的废水中加入Na2S 产生沉淀:Hg2++S2-═Hg+S↓ | |
| C. | Na 与水反应产生气体:2Na+H2O═2Na++2OH-+H2↑ | |
| D. | 向燃煤中加入石灰石可减少 SO2的排放:2CaCO3+O2+2SO2$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4+2CO2 |
18.已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2.某化学兴趣研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物.已知SO3的熔点是16.8℃,沸点是44.8℃.
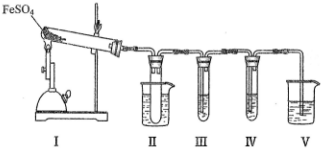
(1)装置II的试管中不装任何试剂,其作用是防止溶液倒吸入装置Ⅰ中(或安全瓶).
(2)装置II的试管浸泡在50℃的水浴中,目的是防止SO3液化或凝固.
(3)装置III和装置IV的作用是探究本实验气体产物成分.请完成实验设计,填写检验试剂、预期现象与结论.
(4)装置V的作用是防止尾气污染环境,烧杯中应加入的试剂是NaOH溶液.

(1)装置II的试管中不装任何试剂,其作用是防止溶液倒吸入装置Ⅰ中(或安全瓶).
(2)装置II的试管浸泡在50℃的水浴中,目的是防止SO3液化或凝固.
(3)装置III和装置IV的作用是探究本实验气体产物成分.请完成实验设计,填写检验试剂、预期现象与结论.
| 检验试剂 | 预期现象与结论 |
| 装置III的试管中加入BaCl2溶液 | 产生白色沉淀,证明气体产物中含有SO3. |
| 装置IV的试管中加入酸性 KMnO4 溶液 | 若溶液紫色褪去, 证明气体产物中含有SO2, 若溶液紫色无明显变化, 证明气体产物中不含SO2 |
19.在常温常压下,烯烃与氢气混合并不起反应,甚至在高温时反应也很慢.但在适当的催化剂存在下与氢气反应生成烷,一般认为加氢反应是在催化剂表面进行.反应过程的示意图如下:下列说法中正确的是( )
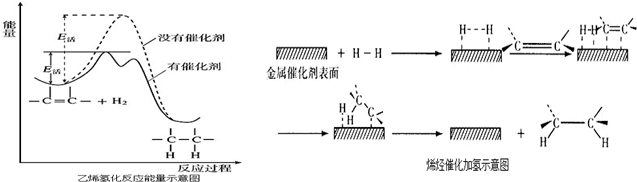

| A. | 乙烯和H2生成乙烷的反应是吸热反应 | |
| B. | 加入催化剂,可减小反应的热效应 | |
| C. | 催化剂能改变平衡转化率,不能改变化学反应的平衡常数 | |
| D. | 催化加氢过程中金属氢化物的一个氢原子和双键碳原子先结合,得到中间体 |