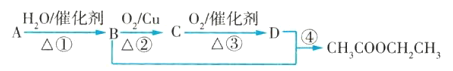
题目内容
【题目】反应 mY(g)+nZ(g)qX(g) ΔH,在不同温度下的平衡体系中,物质 Y 的体积分数随压强变化的曲线如图所示。下列说法正确的是
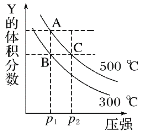
A.m+n<q
B.该反应的ΔH>0
C.A、C 两点化学平衡常数:KA>KC
D.B、C 两点的反应速率:v(B)<v(C)
【答案】D
【解析】
A.根据图象可知,在温度不变时,增大压强,Y的体积分数减小,说明增大压强,化学平衡向正反应方向移动,根据平衡移动原理,增大压强,化学平衡向气体体积减小的方向移动,正反应方向是气体体积减小的反应方向,所以m+n>q,故A错误;
B.根据图象可知:在压强不变时,升高温度,达到平衡时Y的体积分数增大,说明升高温度化学平衡向逆反应方向移动。根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,该反应的正反应是放热反应,所以△H <0,故B错误;
C.A、C点的温度均为500℃, 化学平衡常数只受温度影响,温度不变,K不变,因此KA=KC,故C错误;
D.压强B<C,温度B<C,条件越高化学反应速率越快,所以B、C两点的反应速率v(B)<v(C),故D正确;
故选:D。

 习题精选系列答案
习题精选系列答案【题目】现有 8 种元素的性质、数据如下表所列,它们属于第二或第三周期。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
-2 | -3 | -1 | -3 |
回答下列问题:
(1)④的元素名称是_____,⑧的元素符号是_____。②在元素周期表中的位置是(周期、族)_____ 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_____;名称是________; 碱性最强的化合物的电子式是:_________; 属_____化合物(填“离子”或“共价”)。
(3)①的最简单氢化物的电子式为_____, ⑦的最简单氢化物的电子式为_____,结构式为_____。
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:_________________ 。
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:____________。
【题目】海水是一个巨大的化学资源宝库。

(1)海水中制得的氯化钠可用于生产烧碱及氯气,装置如图所示,下列说法正确的是____(填字母)。

A.阴极反应式是:Na++e-=Na
B.可以用铁做阴极,石墨做阳极
C.烧碱和氯气都在阳极生成
D.离子交换膜是阴离子交换膜(只允许阴离子通过)
(2)苦卤的主要成分是 MgCl2,此外还含 Fe2+、Fe3+、Al3+等离子。已知:生成氢氧化物沉淀的 pH
氢氧化物 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Al(OH)3 | 3.7 | 4.7 |
Mg(OH)2 | 9.6 | 11.1 |
① 步骤 i 中加入 NaClO 的作用是_____,_____。
② 步骤 ii 需在 HCl 保护气中加热进行,HCl 保护气的作用是_____。
③ 若向苦卤中加入石灰乳,可以得到 Mg(OH)2沉淀,用化学平衡移动原理解释该反应过程_____。
(3)海水淡化前需对海水进行预处理。用如图所示 NaClO 的发生装置对海水进行消毒和灭藻处理。

① 装置中由NaCl 转化为NaClO 的离子方程式是_____,_____。
② 定量测定排出的海水中 Cl2 和 ClO-的含量。已知:2![]() +I2 =
+I2 =![]() +2I-。取 25.00 mL 排出的海水,加入过量 KI 溶液,然后用 a mol/LNa2S2O3 溶液滴定生成的 I2,达滴定终点时消耗Na2S2O3 溶液 b mL。该滴定操作选择的指示剂是_____,通过计算可知排出的 海水中 Cl2 和 ClO-的总物质的量浓度是_____mol/L。
+2I-。取 25.00 mL 排出的海水,加入过量 KI 溶液,然后用 a mol/LNa2S2O3 溶液滴定生成的 I2,达滴定终点时消耗Na2S2O3 溶液 b mL。该滴定操作选择的指示剂是_____,通过计算可知排出的 海水中 Cl2 和 ClO-的总物质的量浓度是_____mol/L。