题目内容
在保持平衡的天平的左右两盘中各放一只大小和质量均相同的烧杯,两烧杯中都盛有1mol/L的稀硫酸100mL,然后分别向两烧杯中加入一定质量的金属,充分反应后天平仍保持平衡,则金属的质量分别是( )
分析:向两烧杯中分别加不同质量的两种金属,充分反应后,天平仍保持平衡,说明加入金属的质量与生成氢气的质量差相等,即加入金属反应后烧杯内物质质量增加值相等.由于金属和硫酸的量都知道,可分别写出反应的化学方程式或关系式,需先判断谁过量,按不足量利用差量法计算.
解答:解:硫酸溶液中氢离子物质的量为:n(H+)=1mol/L×0.1L×2=0.2mol,这些氢离子完全反应消耗金属钠、铝和镁的质量分别为:
2Na~2HCl
46g 2mol
m(Na) 0.2mol
m(Na)=46g×0.2mol/2mol=4.6g,
2Al~6HCl
54g 6mol
m(Al) 0.2mol
m(Al)=54g×0.2mol/6mol=1.8g,
Mg~2HCl
24g 2mol
m(Mg) 0.2mol
m(Mg)=24g×0.2mol/2mol=2.4g,
A、由以上计算可知,钠完全反应,镁过量,按不足量计算差量:
2Na~H2 △m
4.6g 0.2g 4.4g
Mg~H2 △m
4.8g 0.2g 4.6g
故A错误;
B、由以上计算可知,钠、铝过量,按不足量计算差量:
2Na~H2 △m
5g 0.2g 4.8g
2Al~3H2 △m
5g 0.2g 4.8g
同时要注意,过量的钠会与水反应产生氢气,故钠的△m小于4.8g,故B错误;
C、由以上计算可知,钠、镁完全反应,按不足量计算差量:
2Na~H2 △m
2.3g 0.1g 2.2g
Mg~H2 △m
2.4g 0.2g 2.2g
故C正确;
D、由以上计算可知,铝、镁与酸恰好完全反应:
2Al~3H2 △m
1.8g 0.2g 1.6g
Mg~H2 △m
2.4g 0.2g 2.2g
故D错误.
故选C.
2Na~2HCl
46g 2mol
m(Na) 0.2mol
m(Na)=46g×0.2mol/2mol=4.6g,
2Al~6HCl
54g 6mol
m(Al) 0.2mol
m(Al)=54g×0.2mol/6mol=1.8g,
Mg~2HCl
24g 2mol
m(Mg) 0.2mol
m(Mg)=24g×0.2mol/2mol=2.4g,
A、由以上计算可知,钠完全反应,镁过量,按不足量计算差量:
2Na~H2 △m
4.6g 0.2g 4.4g
Mg~H2 △m
4.8g 0.2g 4.6g
故A错误;
B、由以上计算可知,钠、铝过量,按不足量计算差量:
2Na~H2 △m
5g 0.2g 4.8g
2Al~3H2 △m
5g 0.2g 4.8g
同时要注意,过量的钠会与水反应产生氢气,故钠的△m小于4.8g,故B错误;
C、由以上计算可知,钠、镁完全反应,按不足量计算差量:
2Na~H2 △m
2.3g 0.1g 2.2g
Mg~H2 △m
2.4g 0.2g 2.2g
故C正确;
D、由以上计算可知,铝、镁与酸恰好完全反应:
2Al~3H2 △m
1.8g 0.2g 1.6g
Mg~H2 △m
2.4g 0.2g 2.2g
故D错误.
故选C.
点评:有关涉及托盘天平平衡的计算题,是高考常考题例.要正确书写出相应的方程式,先判断谁过量,按不足量根据差量法进行相关计算.做题时要注意:活泼金属能与水反应的,还因考虑金属与水的反应.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
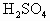 各20mL,向左盘的烧杯中加入10g的Zn,为了保持天平的平衡,应当向右盘的烧杯中放入铁的质量是
各20mL,向左盘的烧杯中加入10g的Zn,为了保持天平的平衡,应当向右盘的烧杯中放入铁的质量是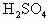 各20mL,向左盘的烧杯中加入10g的Zn,为了保持天平的平衡,应当向右盘的烧杯中放入铁的质量是
各20mL,向左盘的烧杯中加入10g的Zn,为了保持天平的平衡,应当向右盘的烧杯中放入铁的质量是