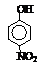题目内容
将0.03mol Cl2缓缓通入含有0.02mol H2SO3和0.02mol HBr的混合液中,则溶液中H+的浓度与通入的氯气的物质的量的关系是下列图中的(纵坐标都表示氢离子的物质的量浓度)( )
A、 |
B、 |
C、 |
D、 |
考点:有关混合物反应的计算
专题:
分析:Cl2能氧化HBr,Br2能氧化H2SO3,氯气首先氧化H2SO3为H2SO4,H2SO3反应完毕,然后再氧化Br-,由于Br-全部转变Br2,所以HBr和H2SO3都完全被氧化.
解答:
解:Cl2能氧化HBr,Br2能氧化H2SO3,氯气首先氧化H2SO3为H2SO4:
Cl2 +H2SO3 +H2O=H2SO4 +2HCl
0.02mol 0.02mol 0.02mol 0.04mol
H2SO3为弱酸,生成两种强酸:H2SO4和HCl,c(H+)增大,H2SO3反应完毕,消耗 Cl20.02mol,Cl2过量0.01mol,然后再氧化Br-:
Cl2 +2HBr=Br2 +2HCl
0.01mol 0.02mol
HBr全部转变为HCl,c(H+)不变,
故选:B.
Cl2 +H2SO3 +H2O=H2SO4 +2HCl
0.02mol 0.02mol 0.02mol 0.04mol
H2SO3为弱酸,生成两种强酸:H2SO4和HCl,c(H+)增大,H2SO3反应完毕,消耗 Cl20.02mol,Cl2过量0.01mol,然后再氧化Br-:
Cl2 +2HBr=Br2 +2HCl
0.01mol 0.02mol
HBr全部转变为HCl,c(H+)不变,
故选:B.
点评:本题考查了氧化还原反应的计算,注意反应的先后顺序,难度不大.

练习册系列答案
相关题目
下列4种醇中,不能被催化氧化的是( )
A、 |
B、 |
C、 |
D、 |
下列说法中,错误的是( )
| A、含有离子键的化合物一定是离子化合物 |
| B、含有共价键的化合物一定是共价化合物 |
| C、共价化合物中一定含有极性共价键,肯定不含离子键 |
| D、离子化合物一定含有离子键,可能含有共价键. |
把VL含有Na2SO4和Al2(SO4)3的混合溶液分成两等分,一份加入含有amolNaOH的溶液,恰好使Al3+完全转化为AlO2-;另一份加入含有bmolBaCl2的溶液,恰好使SO42-完全沉淀为BaSO4,则原混合液中Na+的浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是( )


| A、将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水 |
| B、将pH=11的氨水稀释1000倍,测得pH>8,说明NH3?H2O为弱碱 |
| C、加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3受热不稳定 |
| D、将红热的Pt丝伸入右图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的氧化产物为NO2 |
决定乙醇主要化学性质的原子或原子团是( )
| A、羟基 | B、乙基 |
| C、氢氧根离子 | D、氢离子 |
已知碳酸、亚硫酸常温时的电离平衡常数如下表:则溶液中不能大量共存的离子组合是( )
| 酸 | 电离常数 |
| 碳酸 | Ki1=4×10-7 Ki2=5.6×10-11 |
| 亚硫酸 | Ki1=1.54×10-2 Ki2=1.02×10-7 |
| A、SO32-、HCO3- |
| B、HSO3-、CO32- |
| C、SO32-、CO32- |
| D、HSO3-、HCO3- |