题目内容
12. 汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)?2NO(g)△H>0已知该反应在2404℃时,平衡常数K=64×10-4.请回答:
汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)?2NO(g)△H>0已知该反应在2404℃时,平衡常数K=64×10-4.请回答:(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则N2的反应速率为0.05mol/(L•min).
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志是AD(填字母序号).
A.消耗1mol N2同时生成1mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v正(N2)=v逆(NO)
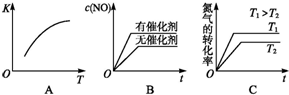
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是AC(填字母序号).
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态.与原平衡状态相比,此时平衡混合气体中NO的体积分数不变(填“变大”“变小”或“不变”).
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol•L-1、4.0×10-2mol•L-1和3.0×10-3mol•L-1,此时反应向正反应方向进行(填“处于化学平衡状态”“向正反应方向进行”或“向逆反应方向进行”),理由是浓度商Qc=$\frac{(3×1{0}^{-3})^{2}}{0.25×0.04}$=9×10-4<K=64×10-4.
分析 (1)5分钟内,△n(O2)=1mol-0.5mol=0.5mol,由N2(g)+O2(g)?2NO(g),可知△n(N2)=0.5mol,再根据v=$\frac{\frac{△n}{V}}{△t}$计算v(N2);
(2)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
(3)A.该反应的正反应为吸热反应,则升高温度平衡向正反应进行,平衡常数增大;
B.加入催化剂,反应速率增大,但平衡不发生移动;
C.升高温度,反应速率增大,平衡向正反应方向移动,氮气的转化率增大;
(4)达到平衡状态后再向其中充入一定量NO等效为在原平衡的基础上增大压强,反应前后气体的物质的量不变,平衡不移动,平衡时相同物质的体积分数相等;
(5)计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行.
解答 解:(1)5分钟内,△n(O2)=1mol-0.5mol=0.5mol,由N2(g)+O2(g)?2NO(g)可知△n(N2)=0.5mol,v(N2)=$\frac{\frac{0.5mol}{2L}}{5min}$═0.05mol/(L•min),
故答案为:0.05mol/(L•min);
(2)A.消耗1mol N2等效于消耗1mol O2,同时生成1mol O2,到达平衡状态,故A正确;
B.混合气体总质量不变,容器容积不变,混合气体密度始终不变,故B错误;
C.混合气体总质量不变,反应前后气体物质的量不变,混合气体平均相对分子质量始终不变,故C错误;
D.由方程式可知2v(N2)正=v(NO)正,而2v正(N2)=v逆(NO),则v正(NO)=v(NO)逆,处于平衡状态,故D正确,
故选:AD;
(3)A.该反应的正反应为吸热反应,则升高温度平衡向正反应进行,平衡常数增大,故A正确;
B.加入催化剂,反应速率增大,但平衡不发生移动,NO浓度不变,故B错误;
C.升高温度,反应速率增大,平衡向正反应方向移动,氮气的转化率增大,故C正确,
故答案为:AC;
(4)达到平衡状态后再向其中充入一定量NO等效为在原平衡的基础上增大压强,反应前后气体的物质的量不变,平衡不移动,平衡时相同物质的体积分数相等,此时平衡混合气中NO的体积分数不变,
故答案为:不变;
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,浓度商Qc=$\frac{(3×1{0}^{-3})^{2}}{0.25×0.04}$=9×10-4<K=64×10-4,则反应应向正反应方向进行,
故答案为:向正反应方向进行;浓度商Qc=$\frac{(3×1{0}^{-3})^{2}}{0.25×0.04}$=9×10-4<K=64×10-4.
点评 本题考查化学平衡的有关计算及影响因素、平衡状态判断、化学平衡图象、平衡常数等,题目难度中等,注意平衡常数的计算和应用.

 名校课堂系列答案
名校课堂系列答案Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
(1)H2SO4溶解Al2O3的离子方程式是Al2O3+6H+=2Al3++3H2O.
(2)将MnO4-氧化Fe2+的离子方程式补充完整:1MnO4-+5Fe2++8H+;=1Mn2++5Fe3++4H2O
(3)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释步骤Ⅱ的目的:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀.
(4)已知:一定条件下,MnO4-可与Mn2+反应生成MnO2.
①向Ⅲ的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是:生成黄绿色气体.
②Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F,氧化性最强的是F.
(3)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(4)A分别与D、E、F、G、H形成的化合物中,最稳定的HF.
(5)在B、C、E、F、G、H中,原子半径最大的是Na.
(6)A和D组成最简单化合物的电子式
 .
.(7)A和E组成化合物的化学式NH3等.
(8)用电子式表示B和H组成化合物的形成过程
 .
.(9)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
①漏斗 ②试管 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥容量瓶 ⑦蒸发皿 ⑧坩埚.
| A. | ①③⑤⑥ | B. | ①②④⑥ | C. | ①③⑤⑦ | D. | ①③⑥⑧ |
| A. | 1:2:3 | B. | 2:1:1 | C. | 4:2:1 | D. | 1:2:4 |
| A. | 采用“绿色化学”工艺,使原料尽可能转化为所需要的物质 | |
| B. | 减少直至不使用对大气臭氧层起破坏作用的氟氯烃 | |
| C. | 大量开采地下水,以满足社会对水的需求 | |
| D. | 节约能源,提高能利用率 |
| A. | 托盘上各放一张滤纸,然后在右盘上添加2g砝码,称取2.0gNaOH固体 | |
| B. | 保存FeSO4溶液时,可以加入铁钉或铁粉来防止Fe2+被氧化 | |
| C. | 向沸水中边滴加FeCl3溶液边用玻璃棒搅拌,可制得Fe(OH)3胶体 | |
| D. | 检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
 碘化钠是制备无机和有机碘化物的原料,在医药上用做祛痰剂和利尿剂等.工业上用铁屑还原法制备NaI,其主要流程如图,请回答下列问题:
碘化钠是制备无机和有机碘化物的原料,在医药上用做祛痰剂和利尿剂等.工业上用铁屑还原法制备NaI,其主要流程如图,请回答下列问题: