题目内容
常温下,将pH=6的盐酸与pH=4的盐酸等体积混合后,溶液中c(OH-)最接近于 .
考点:pH的简单计算
专题:
分析:常温下,pH=6的盐酸溶液中c(H+)=10-6 mol/L、pH=4的盐酸溶液中c(H+)=10-4 mol/L,二者等体积混合后溶液中c(H+)=
mol/L=5.05×10-5 mol/L,则溶液中c(OH-)=
.
| 10-6+10-4 |
| 2 |
| Kw |
| c(H+) |
解答:
解:常温下,pH=6的盐酸溶液中c(H+)=10-6 mol/L、pH=4的盐酸溶液中c(H+)=10-4 mol/L,二者等体积混合后溶液中c(H+)=
mol/L=5.05×10-5 mol/L,则溶液中c(OH-)=
=
mol/L≈1.98×10-10 mol/L,故答案为:1.98×10-10 mol/L.
| 10-6+10-4 |
| 2 |
| Kw |
| c(H+) |
| 10-14 |
| 5.05×10-5 |
点评:本题考查酸酸混合溶液离子浓度计算,侧重考查分析计算能力,正确计算混合酸中氢离子浓度是解本题关键,灵活运用离子积常数解答问题,题目难度不大.

练习册系列答案
相关题目
标准状况下,等质量的O2与O3,一定具有相等的( )
| A、物质的量 | B、分子数目 |
| C、体积 | D、原子数目 |
相同质量的钠在下列情况下产生氢气最多的是( )
①放在足量水中
②放在足量盐酸中
③放在足量CuSO4溶液中
④用刺有小孔的铝,包好放入足量水底中.
①放在足量水中
②放在足量盐酸中
③放在足量CuSO4溶液中
④用刺有小孔的铝,包好放入足量水底中.
| A、①②④ | B、②③④ |
| C、①③④ | D、④ |
儿茶素(其结构简式如图所示)是茶叶的主要活性成分,具有抗氧化、抗菌、除臭等作用.下列说法正确的是( )
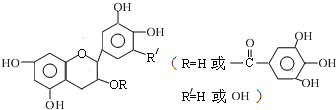

| A、常温下,儿茶素不溶于水,也不溶于有机溶剂 |
| B、儿茶素一定不能发生水解反应 |
| C、1mol儿茶素最少可与5mol NaOH反应 |
| D、儿茶素能与FeCl3溶液发生显色反应 |
将十水碳酸钠与碳酸氢钠的混合物4.54g溶于水,配成100ml溶液.测得溶液中钠离子的物质的量浓度为0.4mol/L,在溶液中加入过量的盐酸,完全反应后,将溶液蒸干灼烧至质量不变,则所得固体的质量为( )
| A、4.54g |
| B、3.34g |
| C、2.57g |
| D、2.34g |


 利用合成氨生产尿素[CO(NH2)2]是重要的化学工艺.在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:3H2(g)+N2(g)?2NH3(g).保持恒温、恒容,测得反应达到平衡时有关数据如下:
利用合成氨生产尿素[CO(NH2)2]是重要的化学工艺.在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:3H2(g)+N2(g)?2NH3(g).保持恒温、恒容,测得反应达到平衡时有关数据如下: