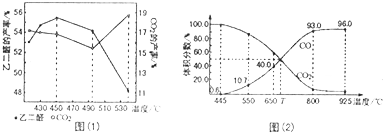
题目内容
5.下列有关说法正确的是( )| A. | pH=5的NH4Cl溶液或醋酸溶液中,由水电离出的 c(H+)均为10-9mol•L-1 | |
| B. | 常温下,将pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 | |
| C. | 在c(H+):c(OH-)=1:l012的溶液中,Na+、I-、NO3-、SO42-能大量共存 | |
| D. | 0.1 mol•L-1 Na2CO3溶液和0.1 mol•L-1 NaHSO4溶液等体积混合,溶液中:c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
分析 A.铵根离子水解,促进了水的电离,氯化铵溶液中的氢离子是水的电离的,而醋酸抑制了水的电离,醋酸中的氢氧根离子是水电离的;
B.醋酸为弱酸,混合液中醋酸过量,溶液显示酸性;
C.c(H+):c(OH-)=1:l012的溶液呈碱性,溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
D.两溶液恰好反应生成碳酸氢钠和硫酸钠,根据混合液中的电荷守恒判断.
解答 解:A.pH=5的NH4Cl溶液中,铵根离子促进了水的电离,则由水电离出的c(H+)为10-5mol•L-1,而醋酸溶液中,醋酸电离出的氢离子抑制了水的电离,醋酸溶液中的氢氧根离子是水的电离的,水电离的氢离子浓度为10-9mol•L-1,故A错误;
B.常温下,将pH=3的醋酸和pH=11的NaOH溶液等体积混合后,由于醋酸为弱酸,则混合液中醋酸过量,混合液呈酸性,溶液的pH<7,故B错误;
C.c(H+):c(OH-)=1:l012的溶液中存在大量氢氧根离子,Na+、I-、NO3-、SO42-之间不发生反应,都不与氢离子反应,在溶液中能够大量共存,故C正确;
D.0.1 mol•L-1 Na2CO3溶液和0.1 mol•L-1 NaHSO4溶液等体积混合,反应后溶质为碳酸氢钠和硫酸钠,根据电荷守恒可知:c(Na+)+c(H+)=2c(CO32-)+2c(SO42-)+c(HCO3-)+c(OH-),故D错误;
故选C.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,涉及离子共存、水的电离及其影响、酸碱混合的定性判断及离子浓度大小比较,明确弱电解质的电离特点为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
5.下列化合物在核磁共振氢谱中能出现两组峰,且其峰面积之比为2:1的有( )
| A. | 乙酸甲酯 | B. | 对苯二酚 | C. | 2-甲基丙烷 | D. | 对苯二甲酸 |
17.短周期元素 A、B、C、D、E 的原子序数依次增大;A 的一种核素在考古时常用来鉴定一些文物的年代,B的氢化物的水溶液呈碱性;C、D为金属元素,且D原子最外层电子数等于其 K 层电子数;若往 E 单质的水溶液中滴加少量紫色石蕊试液,可观察到先变红后褪色.下列说法中,正确的是( )
| A. | B的最高价氧化物对应的水化物的酸性比E强 | |
| B. | 某物质焰色反应呈黄色,该物质一定是含C的盐 | |
| C. | 向D单质与沸水反应后的溶液中滴加酚酞,溶液变红 | |
| D. | B的氢化物的沸点一定高于A的氢化物 |
14.已知a、b、c、d是原子序数依次增大的短周期主族元素,a、c在周期表中的相对位置如下表所示.a元素最低负化合价的绝对值与其原子最外层电子数相等,b是地壳中含量最多的金属元素.下列说法错误的是( )
| a | ||
| c |
| A. | b离子发生水解使溶液呈酸性,c离子发生水解使溶液呈碱性 | |
| B. | 原子半径由小到大的顺序为:d<c<b | |
| C. | a的气态氢化物是造成温室效应的气体之一 | |
| D. | c在氧气中燃烧生成的产物有两种 |
 磷元素在生产和生活中有广泛的应用.
磷元素在生产和生活中有广泛的应用.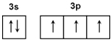 .
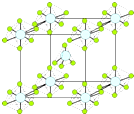
.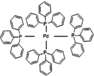 ):P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为sp3;判断该物质在水中溶解度并加以解释不易溶于水.水为极性分子,四(三苯基膦)钯分子为非极性分子,分子极性不相似,故不相溶.该物质可用于如图所示物质A(
):P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为sp3;判断该物质在水中溶解度并加以解释不易溶于水.水为极性分子,四(三苯基膦)钯分子为非极性分子,分子极性不相似,故不相溶.该物质可用于如图所示物质A(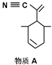 )的合成:物质A中碳原子杂化轨道类型为sp、sp2、sp3;一个A分子中手性碳原子数目为3.
)的合成:物质A中碳原子杂化轨道类型为sp、sp2、sp3;一个A分子中手性碳原子数目为3. 用二氧化氯(CLO2)、高铁酸钠 Na2FeO4摩尔质量为166g•mol-1等新型
用二氧化氯(CLO2)、高铁酸钠 Na2FeO4摩尔质量为166g•mol-1等新型