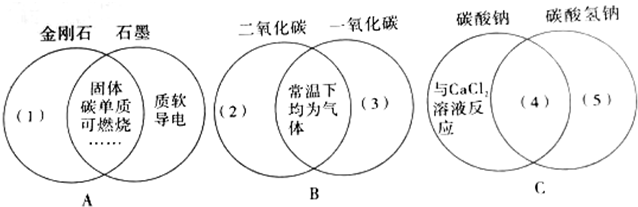
题目内容
3.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):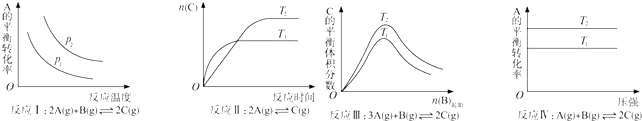
根据以上规律判断,上列结论正确的是( )
| A. | 反应Ⅰ:△H>0,P2>P1 | B. | 反应Ⅱ:△H<0,T1>T2 | ||
| C. | 反应Ⅲ:△H>0,T2<T1;或△H<0,T2>T1 | D. | 反应Ⅳ:△H<0,T2>T1 |
分析 反应Ⅰ说明升高温度,A的转化率降低,增大压强平衡向正反应方向移动;
反应Ⅱ由图象可以看出T1>T2,升高温度C的物质的量减少;
反应Ⅲ中温度的高低与温度对平衡移动的影响有关,由图象可以看出,T2条件下C的平衡体积分数大,因此当T2>T1时正反应为吸热反应△H>0,而当T2<T1时正反应为放热反应△H<0;
反应Ⅳ,由图象可以看出T2条件下A的转化率大,因此当T2>T1时,说明升高温度平衡向正反应方向进行,正反应为吸热反应△H>0,反应为放热反应.
解答 解:A.反应Ⅰ的特点是正反应方向为气体体积减小的方向,结合图象,压强增大A的转化率应增大,所以p2>p1,它随温度的升高A的转化率降低,所以正反应为放热反应△H<0,故A错误;
B.关于反应Ⅱ由图象可以看出T1条件下达到平衡所用的时间少,所以T1>T2,而在T1条件下达平衡时n(C)小,所以说明低温有利于C的生成,故它主要的正反应为放热反应△H<0,故B正确;
C.关于反应Ⅲ,由图象可以看出,T2条件下C的平衡体积分数大,因此当T2>T1时正反应为吸热反应△H>0,而当T2<T1时正反应为放热反应△H<0,故C错误;
D.关于反应Ⅳ,由图象可以看出T2条件下A的转化率大,因此当T2>T1时,说明升高温度平衡向正反应方向进行,因此正反应为吸热反应△H>0,故D错误.
故选B.
点评 本题考查外界条件对化学平衡的影响,题目难度中等,本题注意分析图象中曲线的变化趋势,结合方程式的特征以及外界条件对平衡移动的影响分析.

练习册系列答案
相关题目
1.下列各组离子在水溶液中能大量共存的是( )
| A. | Cu2+ H+ SO42- | B. | Ba2+ NO3- CO32- | ||
| C. | Al3+ H+ CO32- | D. | OH- Cu2+ NO3- |
8. 车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如表:
车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如表:
(1)写出NO与活性炭反应的化学方程式C+2NO?N2+CO2;
(2)计算上述反应T1℃时的平衡常数K1=4;
(3)上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为80%;
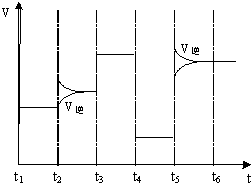
(4)如图为在T1℃达到平衡后在t2、t3、t4、t5时改变某一个反应条件,平衡体系中反应速率随时间变化的情况,且所改变的条件均不同.已知t3-t4阶段为使用催化剂.请判断该反应△H<0(填“>”或“<”).
 车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如表:
车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如表:| 物质 T/℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
(2)计算上述反应T1℃时的平衡常数K1=4;
(3)上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为80%;
(4)如图为在T1℃达到平衡后在t2、t3、t4、t5时改变某一个反应条件,平衡体系中反应速率随时间变化的情况,且所改变的条件均不同.已知t3-t4阶段为使用催化剂.请判断该反应△H<0(填“>”或“<”).
15.1g H2完全燃烧生成液态水放热142.9kJ,下列表示H2燃烧的热化学方程式正确的是( )
| A. | 2H2+O2→2H2O+142.9kJ | B. | 2H2(g)+O2(g)→2H2O(l)+142.9kJ | ||
| C. | 2H2(g)+O2(g)→2H2O(l)+571.6kJ | D. | H2O(l)→H2(g)+$\frac{1}{2}$O2(g)-142.9kJ |
12.革命烈士方志敏同志曾在监狱里用米汤(内含淀粉)给鲁迅先生写过信.鲁迅先生收到信,用一化学试剂一刷后看清了信中内容,可能使用的化学试剂是( )
| A. | 碘化钾 | B. | 溴水 | C. | 碘酒 | D. | 淀粉-KI溶液 |