��Ŀ����
��12�֣�һ���¶���2���ĺ����������У�����2moL̼��2moLCO2�������·�Ӧ�� C(s)+CO2(g)
 2CO(g)
��H��0�����������CO2�����ʵ�����ʱ��t�ı仯��ϵ��ͼ��ʾ��
2CO(g)
��H��0�����������CO2�����ʵ�����ʱ��t�ı仯��ϵ��ͼ��ʾ��

��1���÷�Ӧ�Ħ�S 0������������������������� ����ϸߡ��ϵ͡����¶��������ڸ÷�Ӧ�Է����С�
��2����ʽ�����������¶��´˷�Ӧ��ƽ�ⳣ��K ��
���������һλС����
��3��������ƽ����ϵ����ͨ��CO2����CO2��ת���� ��������С�����䡢��ȷ������
��4����ͬ�¶��£�2���ĺ����������м���4moL̼��4moLCO2���ﵽƽ�⡣����ͼ�л�����������CO2�����ʵ�����ʱ��t�仯��ϵ��Ԥ�ڽ��ʾ��ͼ����ע��ƽ��ʱCO2�����ʵ�����
��5����ͬ�¶��£�2���ĺ����������м���4moL̼��4moLCO2��4moLCO����ʼ��Ӧʱ
V(��) V(��)����� ����������
��1��> �ϸߣ�2��,��1�֣� ��2��K=c2(CO)/C(CO2)=1.242/0.38=4.0 (3��)
��3�����٣�2�֣� ��4����ͼ ��3�֣�����㡢�յ㡢ƽ���߸�1�֣�
 ��5������2�֣�
��5������2�֣�
�����������ݷ���ʽ��֪���÷�Ӧ����ֵ���ӵģ����ڷ�Ӧ�����ȷ�Ӧ�����Ը��ݡ�G����H��T����S��֪��Ҫʹ��Ӧ�Է����У�����Ҫ�ڸ����¡�
��2��ƽ��ʱCO2�����ʵ�����0.67mol��������CO2��1.24mol����������CO��2.48mol�����CO2��CO��Ũ�ȷֱ���0.38mol/L��1.24mol/L������K��c2(CO)/c(CO2)=1.242/0.38=4.0
��3������CO2��Ũ�ȣ���ƽ��������Ӧ����һ������CO2��ת���ʽ��͡�
��4������CO2��Ũ���������Է�Ӧ���ʿ죬�ﵽ��ƽ���ʱ����١�������CO2��xmo��������CO��2xmol��������K��c2(CO)/c(CO2)��x2/(2��0.5x)��4�����x��2mol������ͼ��Ϊ�����𰸣���
��5�����ڴ�ʱc2(CO)/c(CO2)��22/2��2��4�����Է�Ӧ������Ӧ�����ƶ���������Ӧ���ʴ����淴Ӧ���ʡ�

 һ����ʦ�����Ծ�ϵ�д�
һ����ʦ�����Ծ�ϵ�д�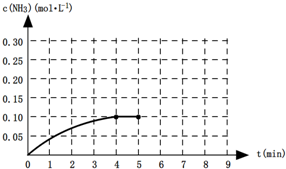
 2CO(g) ��H��0�����������CO2�����ʵ�����ʱ��t�ı仯��ϵ��ͼ��ʾ��
2CO(g) ��H��0�����������CO2�����ʵ�����ʱ��t�ı仯��ϵ��ͼ��ʾ��

