题目内容
3. 一定温度下,某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体)
一定温度下,某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体)(1)该反应的化学方为2A(g)+B(g)?2C(g);
(2)0-2min內B的速率0.1mol/(L•min),A的转化率为40%
(3)在一定温度下,体积不变的密闭容器中,上述反应达到平衡的标志是C(填字母)
A.气体总质量保持不变 B.A、B、C的浓度都相等
C.A、B、C的浓度不再发生变化 D.A、B、C的分子数之比为2:1:2
E.正反应和逆反应都已停止 F.容器内气体密度不再发生变化
(4)反应达到平衡后将容器的容积压缩到原来的$\frac{1}{2}$,其他条件不变,对体系产生的影响是D、E(填字母序号).
A.c(A)减小 B.正反应速率加快,逆反应速率减慢 C.平衡常数K增大
D.C的物质的量增加 E.平衡向正方向移动.
分析 (1)根据图象分析,A与B为反应物,随着反应的进行,物质的量减少,C为生成物,随着反应的进行,物质的量增多,根据反应的转化量之比等于化学方程式中的化学计量数之比,据此写出反应的化学方程式;
(2)反应时间为△t=2min,容器容积为V=5L,B转化的物质的量为△n=2-1=1mol,根据化学反应的平均速率为$\overline{r}(B)$=$\frac{△n}{V△t}$计算,A起始物质的量为5mol,平衡时A的物质的量为3mol,A转化了5-3=2mol,据此计算;
(3)在一定温度下,体积不变的密闭容器中发生上述反应,结合具体的化学方程式,联系常用的判断化学平衡的方法,如温度,密度,压强等,据此进行逐项分析;
(4)反应达到平衡后将容器的容积压缩到原来的$\frac{1}{2}$,等效为对容器进行加压,压强变为原来的两倍,则反应需要向减压的方向进行,压缩体积,瞬间容器内所有物质的浓度均增大,正逆反应速率都增大,但不改变化学平衡常数,据此逐项分析.
解答 解:(1)根据图象分析,A与B为反应物,随着反应的进行,物质的量减少,C为生成物,随着反应的进行,物质的量增多,反应达到平衡的过程中,△n(A)=5-2=2mol,△n(B)=2-1=1mol,△n(C)=4-2=2mol,根据反应的转化量之比等于化学方程式中的化学计量数之比,则化学方程式应为:2A(g)+B(g)?2C(g),
故答案为:2A(g)+B(g)?2C(g);
(2)反应时间为△t=2min,容器容积为V=5L,B转化的物质的量为△n=2-1=1mol,根据化学反应的平均速率为
$\overline{r}(B)$=$\frac{△n}{V△t}$=$\frac{1mol}{5L×2min}$=0.1mol(L•min),A起始物质的量为5mol,平衡时A的物质的量为3mol,A转化了5-3=2mol,则A的转化率为$α=\frac{2mol}{5mol}×100%$=40%,
故答案为:0.1mol/(L•min);40%;
(3)在一定温度下,体积不变的密闭容器中发生上述反应,反应为:2A(g)+B(g)?2C(g),判断化学平衡的标志,
A.根据质量守恒,密闭容器中,化学反应前后质量一直保持不变,不能判断化学反应是否达到平衡,故A不选;
B.A、B、C的浓度达到平衡时并不一定都相等,需视具体的初始条件而定,不能判断化学反应是否达到平衡,故B不选;
C.A、B、C的浓度不再发生变化,达到化学平衡时各组分浓度均不再改变,可以判断化学反应是否达到平衡,故C可选;
D.A、B、C的分子数之比为2:1:2,反应达到平衡时,A、B、C的分子数之比并不一定是2:1:2,需视具体的反应的初始量而定,不能判断化学反应是否达到平衡,故D不选;
E.化学反应达到平衡时动态平衡,正逆反应都还在进行,并没有停止,故E不选;
F.密度为$ρ=\frac{m}{V}$,反应前后质量守恒,m不变,容器为恒容密闭容器,气体总体积也不变,整个反应过程混合气体的密度不变,不能判断化学反应是否达到平衡,故F不选,
故选C;
(4)反应达到平衡后将容器的容积压缩到原来的$\frac{1}{2}$,等效为对容器进行加压,压强变为原来的两倍,则反应需要向减压的方向进行,压缩体积,瞬间容器内所有物质的浓度均增大,正逆反应速率都增大,但不改变化学平衡常数,
A.压缩体积,瞬间容器内所有物质的浓度均增大,反应向正反应方向进行,但不可抵消,即浓度不会再回到原来,总的来讲,浓度还是增大,即c(A)增大,故A错误;
B.加压,正逆反应速率都增大,故B错误;
C.化学平衡常数只随温度的改变而改变,加压不改变化学平衡常数,故C错误;
D.加压使得该反应向正反应方向进行,生成C的物质的量会增多,故D错误;
E.加压使得该反应向正反应方向移动,故E正确,
故选DE.
点评 本题主要考察化学平衡的移动,化学平衡的判断,结合图象得出具体的反应方程式是解题的关键,题目难度不大,是基础题.

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案| A. | 8 种 | B. | 12 种 | C. | 24 种 | D. | 28 种 |
 含氮有机物对乙酰氨基酚(如图)是生活中常见感冒药的主要成分,下列有关对乙酰氨基酚的说法正确的是( )
含氮有机物对乙酰氨基酚(如图)是生活中常见感冒药的主要成分,下列有关对乙酰氨基酚的说法正确的是( )| A. | 对乙酰氨基酚的分子式为:C8H10NO2 | |
| B. | 对乙酰氨基酚可与浓溴水发生加成反应 | |
| C. | 与对乙酰氨基酚互为同分异构体,分子中含有硝基和苯环,且苯环上有三个取代基的分子共有6种 | |
| D. | 对乙酰氨基酚可以与Na2CO3发生反应,产生CO2气体 |
| A. | FeAl合金 | B. | ZnAl合金 | C. | CuMg合金 | D. | MgAl合金 |
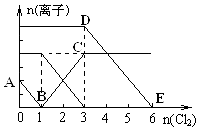 已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )
已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )| A. | 线段BC代表Fe3+ 物质的量的变化情况 | |
| B. | 原混合溶液中c(FeBr2)=6 mol/L | |
| C. | 当通入Cl22mol时,溶液中已发生的反应可表示为2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| D. | 原溶液中n (Fe2+):n (I-):n(Br-)=2:1:3 |

| A. | a极的电极反应为:2H2O+2e-═2OH-+H2↑ | |
| B. | 电解过程中氢氧化钾溶液的浓度保持不变 | |
| C. | b极上CrO42-发生氧化反应生成Cr2O72- | |
| D. | 电解过程中H+从右侧通过离子交换膜迁移到左侧 |
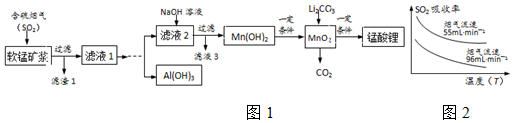
已知:
①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强.
②在此流程中部分金属阳离子生成氢氧化物沉淀的pH如表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
降低通入含硫烟气的温度或减小通入含硫烟气的流速
(2)滤液1中所含金属阳离子有Mn2+、Al3+、Fe2+(填离子符号).
(3)在实际生产中,在实际生产中,Li2CO3与MnO2按物质的量之比为1:4混合均匀加热制取LiMn2O4.
①升温到515℃时,Li2CO3开始分解产生CO2,同时生成固体A,此时比预计Li2CO3的分解温度(723℃)低得多,可能原因是MnO2对Li2CO3的分解有催化剂的作用
②升温到566℃时,MnO2开始分解产生另一种气体X,X恰好与①中产生的CO2物质的量相等,同时得到固体B.请写出此过程发生的化学反应方程式4MnO2 $\frac{\underline{\;566℃\;}}{\;}$2Mn2O3+O2↑
③升温到720℃时,A、B反应,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂.请写出发生的化学反应方程式2Li2O+4Mn2O3+O2$\frac{\underline{\;720℃\;}}{\;}$4LiMn2O4
(4)请补充完整由“滤液1”得到“滤液2”和Al(OH)3的实验方案[Al(OH)3在pH≥12时溶解]:边搅拌边向滤液1中滴加足量过氧化氢,搅拌加入氢氧化钠溶液至4.7≤PH<7.7,过滤得到滤液2和固体向所得固体中加入氢氧化钠溶液至PH≥12,搅拌过滤再向所得滤液中通入二氧化碳过滤洗涤,低温烘干得到氢氧化铝(实验中须用到的试剂有:NaOH溶液、H2O2、CO2)
| A. | 纤维素和淀粉的组成都可用(C6H10O5)n表示,它们互为同分异构体 | |
| B. | 蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 | |
| C. | 人造纤维、合成橡胶和光导纤维都属于有机高分子化合物 | |
| D. | 淀粉、油脂、蛋白质都能水解,但水解产物不同 |
 25℃时,将0.2mol•L?1 CH3COOH溶液逐滴滴入25mL某浓度的NaOH溶液中,
25℃时,将0.2mol•L?1 CH3COOH溶液逐滴滴入25mL某浓度的NaOH溶液中,