题目内容
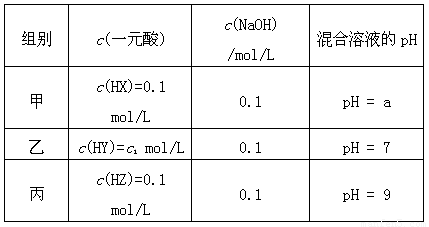
| 组别 | 一元酸 | NaOH | 混合溶液的pH |
| 甲 | c(HX)=0.1mol/L | c(NaOH)=0.1mol/L | pH=a |
| 乙 | c(HY)=c1 mol/L | c(NaOH)=0.1mol/L | pH=7 |
| 丙 | c(HZ)=0.1mol/L | c(NaOH)=0.1mol/L | pH=9 |
| 丁 | pH=2 HZ | pH=12 NaOH | pH=b |
(2)乙组实验中HY为强酸,则HY溶液的pH=
(3)丙组实验发生反应的离子方程式为
(4)丁组实验中b
(2)先根据溶液的酸碱性判断酸的浓度,再根据酸的强弱计算溶液中氢离子的浓度,从而计算溶液的pH值;
(3)酸、碱的物质的量相等溶液呈碱性说明酸是弱酸,根据离子方程式的书写规则书写;根据水的离子积常数和溶液的PH值计算水电离的氢氧根离子浓度;
(4)酸是弱酸,氢离子和氢氧根离子浓度相等时,酸的物质的量远远大于碱的物质的量,导致酸过量,溶液呈酸性.
(2)乙组实验中HY为强酸,等体积混合后溶液呈中性,说明酸的浓度和碱的浓度相等都是0.1mol/L,酸是强酸,所以酸溶液中氢离子浓度是0.1mol/L,酸溶液中pH=1,
故答案为:1;
(3)等物质的量的酸、碱反应后溶液呈碱性乙组实验中HY为强酸,说明酸是弱酸,酸和碱反应的离子方程式为HZ+OH-=H2O+Z-,常温下,PH=9的溶液中氢离子浓度10-9mol/L,则氢氧根离子浓度是10-5mol/L,故答案为:HZ+OH-=H2O+Z-;10-5;
(4)酸是弱酸,酸的PH=2时,酸的浓度大于0.01mol/L,所以等体积的酸和碱混合后酸过量,导致溶液的pH小于7,故答案为:<.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案(8分)常温下,将3种一元酸分别和NaOH溶液等体积混合,实验数据如下:
| 组别 | 一元酸 | NaOH | 混合溶液的pH |
| 甲 | c(HX)="0.1" mol/L | c(NaOH)=0.1mol/L | pH = a |
| 乙 | c(HY)=c1 mol/L | c(NaOH)=0.1mol/L | pH = 7 |
| 丙 | c(HZ)="0.1" mol/L | c(NaOH)=0.1mol/L | pH = 9 |
| 丁 | pH=2 HZ | pH=12 NaOH | pH = b |
混合溶液中离子浓度由大到小顺序为 。
(2)乙组实验中HY为强酸,则HY溶液的pH= 。
(3)丙组实验发生反应的离子方程式为 ,
所得溶液中由水电离出的c (OH-) = mol/L。
(4)丁组实验中b 7(填“<”,“=”或“>”)。
(8分)常温下,将3种一元酸分别和NaOH溶液等体积混合,实验数据如下:
|
组别 |
一元酸 |
NaOH |
混合溶液的pH |
|
甲 |
c(HX)="0.1" mol/L |
c(NaOH)=0.1mol/L |
pH = a |
|
乙 |
c(HY)=c1 mol/L |
c(NaOH)=0.1mol/L |
pH = 7 |
|
丙 |
c(HZ)="0.1" mol/L |
c(NaOH)=0.1mol/L |
pH = 9 |
|
丁 |
pH=2 HZ |
pH=12 NaOH |
pH = b |
(1)甲组实验中HX为弱酸,a 7(填“<”,“=”或“>”),
混合溶液中离子浓度由大到小顺序为 。
(2)乙组实验中HY为强酸,则HY溶液的pH= 。
(3)丙组实验发生反应的离子方程式为 ,
所得溶液中由水电离出的c (OH-) = mol/L。
(4)丁组实验中b 7(填“<”,“=”或“>”)。
常温下,将3种一元酸分别和NaOH溶液等体积混合,实验数据如下:
| 组别 | 一元酸 | NaOH | 混合溶液的pH |
| 甲 | c(HX)=0.1 mol/L | c(NaOH)=0.1mol/L | pH = a |
| 乙 | c(HY)=c1 mol/L | c(NaOH)=0.1mol/L | pH = 7 |
| 丙 | c(HZ)=0.1 mol/L | c(NaOH)=0.1mol/L | pH = 9 |
| 丁 | pH=2 HZ | pH=12 NaOH | pH = b |
(1)甲组实验中HX为弱酸,a______7(填“<”,“=”或“>”),
混合溶液中离子浓度由大到小顺序为 。
(2)乙组实验中HY为强酸,则HY溶液的pH= 。
(3)丙组实验发生反应的离子方程式为 ,
所得溶液中由水电离出的c (OH-) = mol/L。
(4)丁组实验中b 7(填“<”,“=”或“>”)。