题目内容
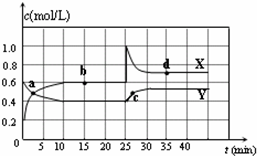
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入一体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图所示.X与Y两条曲线中,Y表示N2O4浓度随时间的变化,则下列说法不正确的是( )

| A.如混合气体的压强不变,说明反应已达化学平衡状态 |
| B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b点 |
| C.25~30 min内用N2O4表示的平均化学反应速率是0.04 mol?L-1?min-1 |
| D.反应进行至25 min时,曲线发生变化的原因是增加N2O4浓度 |

由图可知10-25min平衡状态时,X表示的生成物的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,Y表示的反应物的浓度变化量为(0.6-0.4)mol/L=0.2mol/L,X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示
NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线.
A、该反应酯化反应为气体物质的量减少的反应,容器体积不变,随反应进行体系压强降低,压强不变,说明反应已达化学平衡状态,故A正确;
B、由图可知,10-25min及35min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,即b处于化学平衡状态,故B正确;
C、由图象可知,25~30 min内用N2O4的浓度变化量为(0.6-0.4)mol/L=0.2mol/L,所以v(N2O4)=
=0.04mol/(L?min),故C正确;
D、25min时,X的浓度增大,Y的浓度不变,只能是增大X的浓度,所以曲线发生变化的原因是增加NO2浓度,故D错误.
故选:D.
NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线.
A、该反应酯化反应为气体物质的量减少的反应,容器体积不变,随反应进行体系压强降低,压强不变,说明反应已达化学平衡状态,故A正确;
B、由图可知,10-25min及35min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,即b处于化学平衡状态,故B正确;
C、由图象可知,25~30 min内用N2O4的浓度变化量为(0.6-0.4)mol/L=0.2mol/L,所以v(N2O4)=
| 0.2mol/L |
| 5min |
D、25min时,X的浓度增大,Y的浓度不变,只能是增大X的浓度,所以曲线发生变化的原因是增加NO2浓度,故D错误.
故选:D.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法正确的是( )
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法正确的是( )| A、图中的两条曲线,X是表示NO2浓度随时间的变化曲线 | B、a、b、c、d四个点中,只有b、d点的化学反应处于平衡状态 | C、25 min时,导致平衡移动的原因是将密闭容器的体积缩小为1L | D、前10 min内用v(NO2)表示的化学反应速率为0.06 mol/(L?min) |
 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入一定体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图所示.
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入一定体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图所示.
 和
和 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式 (2009?宿迁二模)已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法正确的是( )
(2009?宿迁二模)已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法正确的是( ) 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)(正反应为放热反应).现将一定量NO2 和N2O4 的混合气体通入一体积为1L的恒温密闭容器中,反应物的浓度随时间变化的关系曲线如图所示.请回答下列问题:
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)(正反应为放热反应).现将一定量NO2 和N2O4 的混合气体通入一体积为1L的恒温密闭容器中,反应物的浓度随时间变化的关系曲线如图所示.请回答下列问题: