题目内容
2.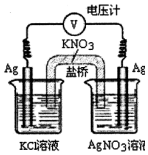 实验室利用如图所示装置,通过测电压求算Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法正确的是( )
实验室利用如图所示装置,通过测电压求算Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法正确的是( )| A. | 该装置工作时电能转化为化学能 | |
| B. | 左池中的电极增重比右池中电极更大 | |
| C. | 盐桥中的K+向左池方向移动 | |
| D. | 总反应为Ag+(aq)+C1-(aq)=AgCl(s) |
分析 A、该电池是原电池;
B、左池中银失电子发生氧化反应为负极;
C、阳离子向正极移动;
D、总的电极反应式为:Ag++Cl-═AgCl↓.
解答 解:A、该电池是原电池,将化学能转化为电能,故A错误;
B、左池中银失电子发生氧化反应为负极,同时生成氯化银沉淀,而右池中银离子得电子生成单质银,根据转移电子数目相等,得Cl-~Ag,所以左池增加35.5g右池增加108g,左池中的电极增重比右池中电极更小,故B错误;
C、阳离子向正极移动,左池是负极右池是正极,所以盐桥中的K+向右池方向移动,故C错误;
D、总的电极反应式为:Ag++Cl-═AgCl↓,故D正确;
故选D.
点评 本题考查原电池知识,侧重于原电池的设计,注意把握电解方程式的书写以及原电池的工作原理,难度不大.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
12.已知硫酸亚铁溶液中加入过氧化钠时发生反应:4Fe2++4Na2O2+6H2O═4Fe(OH)3↓+O2↑+8Na+,则下列说法正确的是( )
| A. | 该反应中FeSO4只做还原剂,Na2O2只做氧化剂 | |
| B. | 反应中氧化剂与还原剂的物质的量之比为3:5 | |
| C. | 该反应中由4 mol Fe2+还原的Na2O2是3 mol | |
| D. | 4 mol Na2O2在反应中共得到8NA个电子 |
13.下列过程吸收热量的是( )
| A. | 钠和水反应 | B. | 铝热反应 | C. | 液氨气化 | D. | 镁条燃烧 |
10.明矾是一种常用的净水剂,明矾不属于( )
| A. | 盐 | B. | 化合物 | C. | 混合物 | D. | 硫酸盐 |
17.短周期主族元素X、Y、Z、W的原子序数依次增大,其中原子半径$\frac{r(Z)}{r(X)}$的比值在短周期主族元素中为最大值,而W的原子核外电子数是同主族元素Y的2倍.则下列说法正确的是( )
| A. | 简单离子半径:Z>Y | |
| B. | X可分别与Y、Z、W组成共价化合物 | |
| C. | W的最高价含氧酸的酸式盐一定显酸性 | |
| D. | ZYX溶液与ZXW溶液呈碱性的原理相同 |
7.五倍子是一种常见的中草药,其有效成分为X.在一定条件下X可分别转化为Y、Z.
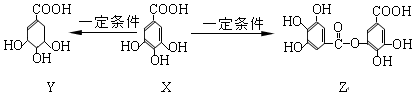
下列说法错误的是( )

下列说法错误的是( )
| A. | 1molZ最多能与7molNaOH发生反应 | |
| B. | 1molX最多能与2molBr2发生取代反应 | |
| C. | Y分子结构中有3个手性碳原子 | |
| D. | Y能发生加成、取代、消去、氧化、缩聚反应 |
14.关于化学反应与能量的说法正确的是( )
| A. | 形成化学键时吸收能量 | |
| B. | 中和反应是吸热反应 | |
| C. | 燃烧属于放热反应 | |
| D. | 反应物总能量与生成物总能量一定相等 |
6.已知H 2A为弱酸,下列说法错误的是( )
| A. | 0.1mol/L的Na 2A溶液中:c(A 2-)+c(HA -)+c(H 2A)=0.1mol/L | |
| B. | 常温下,将pH=3的H 2A溶液稀释到原来的100倍,则稀释后溶液的pH<5 | |
| C. | 常温下,将pH=3的H 2A溶液与pH=11的NaOH溶液等体积混合,反应混合液呈酸性 | |
| D. | 常温下,若1mol/L的NaHA溶液的pH=9,则溶液中:c(Na +)-c(HA -)-c(A 2-)=10 -5-10 -9 |
7.下列物质不能由两种单质直接化合得到的是( )
| A. | Fe3O4 | B. | Na2O2 | C. | NO | D. | FeCl2 |