题目内容
16.某一溶液里可能含有的离子是:SO42-、CO32-、SO32-、Cl-.请阅读下列叙述后完成后面的空格内容.(1)当溶液中存在大量的H+时,溶液中不能存在的离子是CO32-、SO32-;
(2)当溶液中存在大量的Ba2+时,溶液中不能存在的离子是SO42-、CO32-、SO32-;
(3)向溶液通入足量氯气时,离子在溶液中不能大量存在CO32-、SO32-.
分析 (1)与氢离子结合生成气体、水等的离子不能存在;
(2)与钡离子结合生成沉淀的离子不能存在;
(3)向溶液通入足量氯气时,溶液含盐酸,且具有氧化性.
解答 解:(1)当溶液中存在大量的H+时,溶液中不能存在的离子是CO32-、SO32-,结合生成水和气体不能共存,故答案为:CO32-、SO32-;
(2)当溶液中存在大量的Ba2+时,溶液中不能存在的离子是SO42-、CO32-、SO32-,结合生成沉淀不能共存,故答案为:SO42-、CO32-、SO32-;
(3)向溶液通入足量氯气时,离子在溶液中不能大量存在CO32-、SO32-,与酸反应,且SO32-与氯气发生氧化还原反应不共存,故答案为:CO32-、SO32-.
点评 本题考查离子共存、离子反应,为高频考点,把握离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
6.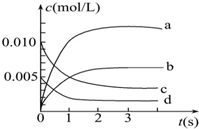 在2L密闭容器内,800℃时发生反应:2NO(g)+O2(g)═2NO2(g),在体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时发生反应:2NO(g)+O2(g)═2NO2(g),在体系中,n(NO)随时间的变化如表:
(1)上述反应是(填“是”或“不是”)可逆反应,在第5s时,NO的转化率为65%.
(2)如图中表示NO2变化曲线的是b.用O2表示从0~2s内该反应的平均速率v=0.001 5 mol/(L•s).
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内气体密度保持不变.
 在2L密闭容器内,800℃时发生反应:2NO(g)+O2(g)═2NO2(g),在体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时发生反应:2NO(g)+O2(g)═2NO2(g),在体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| NO的物质的量(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2变化曲线的是b.用O2表示从0~2s内该反应的平均速率v=0.001 5 mol/(L•s).
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内气体密度保持不变.
4.已知有如下反应:
①2BrO3-+Cl2═Br2+2ClO3-
②ClO3-+5Cl-+6H+═3Cl2+3H2O
③2FeCl2+Cl2═2FeCl3
④2FeCl3+2KI═2FeCl2+2KCl+I2
下列各微粒氧化能力由强到弱的顺序正确的是( )
①2BrO3-+Cl2═Br2+2ClO3-
②ClO3-+5Cl-+6H+═3Cl2+3H2O
③2FeCl2+Cl2═2FeCl3
④2FeCl3+2KI═2FeCl2+2KCl+I2
下列各微粒氧化能力由强到弱的顺序正确的是( )
| A. | ClO3->BrO3->Cl2>Fe3+>I2 | B. | BrO3->Cl2>ClO3->I2>Fe3+ | ||
| C. | BrO3->ClO3->Cl2>Fe3+>I2 | D. | BrO3->ClO3->Fe3+>Cl2>I2 |
1.下列有关同分异构体的叙述正确的是( )
| A. | CH3CH2CH=CHCH2CH3不存在顺反异构体 | |
| B. | 分子式为C5H10O2的羧酸有8种 | |
| C. | 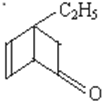 的属于芳香族化合物的同分异构体中不与金属钠反应的有5种 的属于芳香族化合物的同分异构体中不与金属钠反应的有5种 | |
| D. | 棱晶烷  为正三棱柱形,它的二氯代物有5种 为正三棱柱形,它的二氯代物有5种 |
8.下列化合物中的所有碳原子都一定在同一平面上的是( )
| A. | CH3(CH2)4CH3 | B. | CH3CH2CHO | C. | CH3CH=CHCH3 | D. | (CH3)3C-C≡C-CH3 |
5.将淀粉浆和淀粉酶的混合物放入玻璃纸袋中,扎好袋口,浸入流动的温水中.相当一段时间后,取袋内液体分别与碘水、新制Cu(OH) 2(加热)和浓HNO 3(微热)作用,其现象分别是( )
| A. | 显蓝色、无现象、显黄色 | B. | 显蓝色、红色沉淀、无现象 | ||
| C. | 无现象、变黑色、显黄色 | D. | 显蓝色、变红色、黄色沉淀 |
6.下列物质分子中,所有原子都处在同一平面上的是( )
| A. | 环丙烷 | B. | CH3-CH═CH2 | C. | 苯甲烷 | D. | CH≡CH |

 .
.