题目内容
19. Q、R、X、Y、Z、L六种元素的原子序数依次增大,R和L是同主族元素,R的最外层电子数比次外层电子数少1,L的单质常温常压下是紫黑色固体,Q和X形成的离子化合物XQ是碱石灰的主要成分,X、Y、Z位于同一周期,Y的外围电子数是最外层电子的6倍,Z位于ds区且不能和稀硫酸反应生成H2,请问答下列问题:
Q、R、X、Y、Z、L六种元素的原子序数依次增大,R和L是同主族元素,R的最外层电子数比次外层电子数少1,L的单质常温常压下是紫黑色固体,Q和X形成的离子化合物XQ是碱石灰的主要成分,X、Y、Z位于同一周期,Y的外围电子数是最外层电子的6倍,Z位于ds区且不能和稀硫酸反应生成H2,请问答下列问题:(1)L的价层电子轨道示意图为
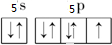 ,L的含氧酸HLO3中L的杂化方式为sp3,酸根LO3-的离子构型为三角锥形;
,L的含氧酸HLO3中L的杂化方式为sp3,酸根LO3-的离子构型为三角锥形;(2)ZR42-的配体是Cl-,ZR42-是黄色的,而ZR2的稀溶液是浅蓝色,说明原因稀溶液中主要形成[Cu(H2O)4]2+配离子;
(3)Y的氧化物呈如图所示的无限链状结构,则该氧化物的化学式为CrO3;
(4)X和Z的晶体堆积模型相同,列式计算晶体X的空间利用率74%,己知X原子半径约为200pm,则晶体X的密度为1.5g/cm3(计算结果保留两位有效数字);
(5)XL2晶体含有层状结构,其层内有强极性共价键,层外有范德华力相连接,则XL2的晶体类型是混合型晶体或过渡型晶体.
分析 R和L是同主族元素,R的最外层电子数比次外层电子数少1,R为Li或Cl,L的单质常温常压下是紫黑色固体,应为I2,则R为Cl,L为I元素,Q和X形成的离子化合物XQ是碱石灰的主要成分,可知Q为O元素,X为Ca元素,X、Y、Z位于同一周期,为第四周期,Y的外围电子数是最外层电子的6倍,外围电子排布为3d54s1,应为Cr元素,Z位于ds区且不能和稀硫酸反应生成H2,应为Cu,以此解答该题.
解答 解:R和L是同主族元素,R的最外层电子数比次外层电子数少1,R为Li或Cl,L的单质常温常压下是紫黑色固体,应为I2,则R为Cl,L为I元素,Q和X形成的离子化合物XQ是碱石灰的主要成分,可知Q为O元素,X为Ca元素,X、Y、Z位于同一周期,为第四周期,Y的外围电子数是最外层电子的6倍,外围电子排布为3d54s1,应为Cr元素,Z位于ds区且不能和稀硫酸反应生成H2,应为Cu,
(1)L为I元素,最外层有7个电子,价层电子轨道示意图为 ,I的含氧酸HIO3中I形成3个δ键,且有1个孤电子对,为sp3杂化,酸根IO3-的离子构型为三角锥形,
,I的含氧酸HIO3中I形成3个δ键,且有1个孤电子对,为sp3杂化,酸根IO3-的离子构型为三角锥形,
故答案为: ;sp3;三角锥形;
;sp3;三角锥形;
(2)CuCl42-的配体为Cl-,稀溶液中主要形成[Cu(H2O)4]2+配离子,CuCl2的稀溶液是浅蓝色,
故答案为:Cl-;稀溶液中主要形成[Cu(H2O)4]2+配离子;
(3)由限链状结构结构可知每个Cr对应的O原子个数为2+2×$\frac{1}{2}$=3,氧化物为CrO3,故答案为:CrO3;
(4)铜晶胞中铜原子位于顶点和面心,即晶胞类型为面心立方堆积,铜原子半径为r,则晶胞边长=2$\sqrt{2}$r,晶胞体积V=(2$\sqrt{2}$r)3,每个晶胞中铜原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则空间利用率为$\frac{\frac{4}{3}×π}{(2\sqrt{2})^{3}}$×100%=74%,
己知X原子半径约为200pm,
则ρ=$\frac{m}{V}$=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{256}{{N}_{A}}}{(2\sqrt{2}×200×1{0}^{-10})^{3}}$g/cm3=1.5g/cm3,
故答案为:74%;1.5;
(5)XL2晶体含有层状结构,其层内有强极性共价键,层外有范德华力相连接,则XL2的晶体类型是混合型晶体或过渡型晶体,
故答案为:混合型晶体或过渡型晶体.
点评 本题考查了物质结构及其性质,涉及原子杂化方式的判断、价电子排布式的书写、元素周期律、晶胞的计算等知识点,题目综合性较强,注意根据价层电子对互斥理论、构造原理等知识来分析解答,题目难度大.

| A. | 压强不再随时间而改变时 | |
| B. | 混合气体中各组成成分的含量不再改变时 | |
| C. | 气体的总质量不再改变时 | |
| D. | 单位时间内消耗1 mol I2,同时有2 mol HI生成时 |
| A. | 原子的核电荷数依次增多 | B. | 原子核外电子层数依次增多 | ||
| C. | 原子核外次外层电子数依次增多 | D. | 原子量依次增大 |
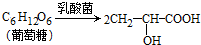
实验(一):乳酸的制取
步骤1:取14.40g葡萄糖(相对分子质量为180)于烧杯中,加人乳酸菌(厌氧)发酵,72小时后,过滤,将滤液转移到仪器A中,定容,得到500mL原液;
步骤2:取20.00mL原液于锥形瓶中,加人酚酞指示剂,用浓度为0.1000mol/L的NaOH溶液滴定至终点,重复4次,数据记录如下表.(假定原液中其他物质不与NaOH反应)
| 次数 | 1 | 2 | 3 | 4 |
| 滴定体积(mL) | 19.22 | 19.18 | 19.80 | 19.20 |
(2)如何判断已到达滴定终点当滴入最后一滴标准液时,锥形瓶中无色溶液变红色,且半分钟内不褪色;
(3)乳酸的产率为30%.
实验(二):乳酸的性质
已知乳酸的Ka=1.4×10-4,碳酸的Ka1=4.47×10-7.
(4)设计实验证明乳酸是弱酸:取0.1mol/L乳酸溶液于烧杯中,用PH计测定其PH值,若PH大于1,说明乳酸是弱酸或(常温下取0.1mol/L乳酸钠溶液于烧杯中,用pH计测定其PH值,若PH大于7,说明乳酸是弱酸)或(取PH=a乳酸溶液于烧杯中,加水稀释10n倍,用PH计测定其PH值,若PH小于a+n说明乳酸是弱酸);
(5)小组利用如图所示的仪器和药品,通过实验来比较乳酸和碳酸的酸性强弱.
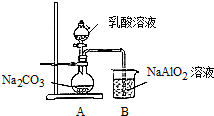
①可观察到烧杯中的现象是溶液出现白色浑浊;
写出烧杯中发生的化学反应方程式2NaAlO2+3H2O+CO2═2Al(OH)3↓+Na2CO3或NaAlO2+2H2O+CO2═Al(OH)3↓+NaHCO3;
②学习小组中有成员提出上述实验设计不够严谨,请你提出改进的措施在A与B之间增加一个装有碳酸氢钠溶液的洗气瓶.
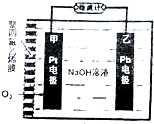 氧电化学传感器可用于测定O2含量,下图为某种氧电化学传感器的原理示意图,已知在测定O2含量过程中,电解质溶液的质量保持不变,一段时间内,若通过传感器的待测气体为aL(标准状况),某电极增重了bg.下列说法正确的是( )
氧电化学传感器可用于测定O2含量,下图为某种氧电化学传感器的原理示意图,已知在测定O2含量过程中,电解质溶液的质量保持不变,一段时间内,若通过传感器的待测气体为aL(标准状况),某电极增重了bg.下列说法正确的是( )| A. | Pt电极上发生氧化反应 | |
| B. | Pt上发生的电极反应式为4OH--4e-═O2↑+2H2O | |
| C. | 反应过程中转移OH-的物质的量为0.25bmol | |
| D. | 待测气体中氧气的体积分数为0.7$\frac{b}{a}$ |
| 沸点/℃ | 水溶性 | |
| 甲醇 | 65 | 与水混溶 |
| 甲醛 | -21 | 与水混溶 |
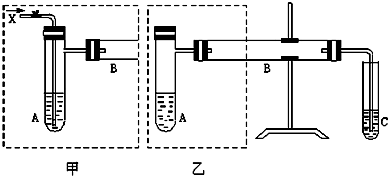
如图是两个同学设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如甲和乙所示,请回答下列问题:
(1)在仪器组装完成后,加装试剂前必须要进行的操作是检查装置气密性.
(2)若按甲装置进行实验,则通入A的X是空气或氧气,B中发生反应的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(3)若按乙装置进行实验,则B管中应装入的物质是氧化铜,B中发生反应的化学方程式为CH3OH+CuO$→_{△}^{Cu}$Cu+HCHO+H2O.
(4)试管C中应装入的试剂是水.
(5)两套装置中都需要加热的仪器有A、B(填A、B、C).
(6)若欲得到较浓的甲醛溶液,你认为选用哪套装置较好?甲(填“甲”或“乙”).
(7)请设计简单的实验,检验实验后C中所得液体确为甲醛溶液.简述所用试剂、操作、现象及结论.在试管中加入少量新制Cu(OH)2悬浊液,取少量C中液体滴入试管中,加热,有红色沉淀生成,证明C中所得液体为甲醛溶液.
 .
. .
. .
. .
. :
: