题目内容
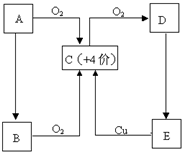 A、B、C、D、E五种物质有如图所示的转化关系,且物质A是一种淡黄色的固体.
A、B、C、D、E五种物质有如图所示的转化关系,且物质A是一种淡黄色的固体.(1)写出A、C、E物质的化学式.
A
(2)试管壁上如果沾有A,应用
(3)对于C:
①将C分别通入下列溶液时有何现象,并说明产生这种现象的原因.
A.澄清石灰水:现象
原因
B.品红溶液:现象
原因
②若将C和氯气等体积混合,然后通入品红溶液,现象与①有何不同
(4)浓的E溶液在常温下为粘稠的液体,且E具有强吸水性、强氧化性、强脱水性.则
①E表现吸水性时,可做干燥剂,下列物质可用E干燥的是
A.氨气 B.硫化氢C.氢气 D.二氧化硫
②浓E溶液与铜反应时,E除了表现强氧化性外,还表现了
分析:物质A是一种淡黄色的固体,中学阶段常见有过氧化钠或硫,A能与氧气反应,则应为S,则C为SO2,由此可知D为SO3,E为H2SO4,B由A生成,与氧气反应也可生成SO2,则可知B应为H2S,结合对应物质的性质以及题目要求解答该题.
解答:解:物质A是一种淡黄色的固体,中学阶段常见有过氧化钠或硫,A能与氧气反应,则应为S,则C为SO2,由此可知D为SO3,E为H2SO4,B由A生成,与氧气反应也可生成SO2,则可知B应为H2S,
(1)由以上分析可知A为S,B为SO2,E为H2SO4,故答案为:S;SO2;H2SO4;
(2)S不溶于水,微溶于酒精,易溶于二硫化碳,可与热的氢氧化钠反应,则试管上沾有S,可用CS2或热的NaOH溶液洗涤,故答案为:CS2或热的NaOH溶液;
(3)①.A.二氧化硫可与澄清石灰水反应生成亚硫酸钙沉淀,可观察到溶液变浑浊,反应的化学方程式为SO2+Ca(OH)2=CaSO3↓+H2O,
故答案为:变浑浊;SO2+Ca(OH)2=CaSO3↓+H2O;
B.二氧化硫具有漂白性,可使品红褪色,故答案为:褪色;SO2具有漂白性;
②二氧化硫具有还原性,可与氯气发生氧化还原反应生成硫酸和盐酸,反应的方程式为SO2+Cl2+2H2O=H2SO4+2HCl,将二者混合通入品红中,溶液不褪色,
故答案为:品红不褪色;SO2+Cl2+2H2O=H2SO4+2HCl;
(4)①浓硫酸具有吸水性,可用作干燥剂,但不能干燥碱性或具有强还原性气体,可干燥二氧化硫和氢气,故答案为:CD;
②浓硫酸与铜反应生成硫酸铜和二氧化硫,反应中浓硫酸表现为酸性和强氧化性,故答案为:酸.
(1)由以上分析可知A为S,B为SO2,E为H2SO4,故答案为:S;SO2;H2SO4;
(2)S不溶于水,微溶于酒精,易溶于二硫化碳,可与热的氢氧化钠反应,则试管上沾有S,可用CS2或热的NaOH溶液洗涤,故答案为:CS2或热的NaOH溶液;
(3)①.A.二氧化硫可与澄清石灰水反应生成亚硫酸钙沉淀,可观察到溶液变浑浊,反应的化学方程式为SO2+Ca(OH)2=CaSO3↓+H2O,
故答案为:变浑浊;SO2+Ca(OH)2=CaSO3↓+H2O;
B.二氧化硫具有漂白性,可使品红褪色,故答案为:褪色;SO2具有漂白性;
②二氧化硫具有还原性,可与氯气发生氧化还原反应生成硫酸和盐酸,反应的方程式为SO2+Cl2+2H2O=H2SO4+2HCl,将二者混合通入品红中,溶液不褪色,
故答案为:品红不褪色;SO2+Cl2+2H2O=H2SO4+2HCl;
(4)①浓硫酸具有吸水性,可用作干燥剂,但不能干燥碱性或具有强还原性气体,可干燥二氧化硫和氢气,故答案为:CD;
②浓硫酸与铜反应生成硫酸铜和二氧化硫,反应中浓硫酸表现为酸性和强氧化性,故答案为:酸.
点评:本题考查无机物的推断,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意把握物质的性质,根据转化关系判断物质的可能性,二氧化硫的性质为中学阶段常考查内容,学习中注意相关知识的学习和积累,难度不大.

练习册系列答案
相关题目






 元素周期表短周期的一部分如表所示.下列有关A、B、C、D、E五种元素的叙述中,正确的是( )
元素周期表短周期的一部分如表所示.下列有关A、B、C、D、E五种元素的叙述中,正确的是( )