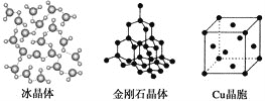
题目内容
【题目】下列叙述正确的是
A. 常温下,78 g Na2O2中含有的阴离子数是2NA
B. 标况下,22.4 L CCl4含有的共价键数是4NA
C. 2.4g镁在足量氧气中燃烧,转移的电子数是0.1NA
D. 铁铝混合物与一定量稀盐酸反应生成1 mol H2时,转移电子数是2NA
【答案】D
【解析】
Na2O2中的阴离子是![]() ;标况下, CCl4是液体;根据
;标况下, CCl4是液体;根据![]() 分析 ;
分析 ;
根据2H++2e-=H2分析。
Na2O2中的阴离子是![]() ,78 g Na2O2的物质的量是1mol,含有的阴离子数是NA,故A错误;标况下, CCl4是液体,故B错误;
,78 g Na2O2的物质的量是1mol,含有的阴离子数是NA,故A错误;标况下, CCl4是液体,故B错误;![]() ,2.4g镁的物质的量是0.1mol,在足量氧气中燃烧,转移的电子数是0.2NA,故C错误; 根据2H++2e-=H2,生成1 mol H2时,转移电子数是2NA,故D正确。
,2.4g镁的物质的量是0.1mol,在足量氧气中燃烧,转移的电子数是0.2NA,故C错误; 根据2H++2e-=H2,生成1 mol H2时,转移电子数是2NA,故D正确。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】![]() 盐酸与
盐酸与![]() 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。

回答下列问题:
(1)从实验装置上看,图中尚缺少一种玻璃仪器,这种玻璃仪器的名称是____________________。能否改用铜丝_______(填“能、否”),原因是____________________________
(2)大烧杯上如不盖硬纸板,测得的中和热数值会__________(填“偏大”“偏小”或“无影响”)。
(3)实验中改用![]() 盐酸跟
盐酸跟![]() 溶液进行反应,与上述实验相比,所放出的热量__________(填“偏大”“相等”或“偏小”),所求中和热__________(填“相等”或“不相等”)。
溶液进行反应,与上述实验相比,所放出的热量__________(填“偏大”“相等”或“偏小”),所求中和热__________(填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替![]() 溶液进行上述实验,测得的中和热数值会__________(填“偏大”“偏小”或“无影响”)。
溶液进行上述实验,测得的中和热数值会__________(填“偏大”“偏小”或“无影响”)。
(5)取![]() 溶液和
溶液和![]() 硫酸溶液进行实验,实验数据如下表。
硫酸溶液进行实验,实验数据如下表。
温度 实验次数 | 起始温度 | 终止温度
| 温度差平均值
| ||
|
| 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | _________________ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
则中和热![]() __________(取小数点后一位。)(本题中
__________(取小数点后一位。)(本题中![]() 溶液和硫酸溶液的密度均取
溶液和硫酸溶液的密度均取![]() ,中和后生成溶液的比热容取
,中和后生成溶液的比热容取![]() )
)
【题目】对于数以千万计的化学物质和为数更多的化学反应,分类的作用几乎是无可替代的。下列物质分类的正确组合是( )
混合物 | 化合物 | 单质 | 盐 | |
A | 盐酸 | NaOH溶液 | 石墨 | 食盐 |
B | 生理盐水 | KNO3晶体 | O3 | 纯碱 |
C | 氢氧化铁胶体 | 澄清石灰水 | 铁 | 石灰石 |
D | CuSO4·5H2O | CaCl2 | 水银 | CaO |
A.AB.BC.CD.D
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①___ | ②___ |
制备纯净NO | Cu | ③___ | ④___ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③装置Ⅶ的作用是____________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气, 该反应的化学方程式为__________________。