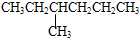题目内容
一定条件下,在容积不变的密闭容器中,对于可逆反应2NO2(g)?2NO(g)+O2(g),能说明这一反应已达到化学平衡状态的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率之比为2:2:1
④混合气体的颜色不再改变.
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率之比为2:2:1
④混合气体的颜色不再改变.
| A、①④ | B、②③ | C、①③ | D、全部 |
考点:化学平衡状态的判断
专题:化学平衡专题
分析:反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断.
解答:
解:①生成n mol O2的同时生成2n mol NO2,说明正逆反应速率相等,反应达到平衡状态,故①正确;
②生成氧气和生成NO都是正向进行反应,不能表明正逆反应速率相等,故②错误;
③化学反应速率之比等于其化学计量数之比,这不能作为判断是否达到平衡的依据,故③错误;
④混合气体的颜色不再改变,说明NO2气体的浓度不变,达到平衡状态,故④正确;
故选A.
②生成氧气和生成NO都是正向进行反应,不能表明正逆反应速率相等,故②错误;
③化学反应速率之比等于其化学计量数之比,这不能作为判断是否达到平衡的依据,故③错误;
④混合气体的颜色不再改变,说明NO2气体的浓度不变,达到平衡状态,故④正确;
故选A.
点评:本题考查平衡状态的判断,对于反应前后气体的计量数之和不相等的可逆反应来说,可从浓度、温度、颜色、压强、百分含量等角度判断是否达到平衡状态.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列物质熔沸点高低比较正确的是( )
| A、SiO2<CO2 |
| B、CCl4<CF4 |
| C、NaCl<HCl |
| D、HF>HCl |
下列反应的离子方程式正确的是( )
| A、碳酸镁溶于硫酸溶液 MgCO3+2H+═Mg2++H2O+CO2↑ |
| B、澄清的石灰水跟稀硝酸反应 Ca(OH)2+2H+=Ca2++2H2O |
| C、氧化钠与稀H2SO4混合 O2-+2H+=H2O |
| D、碳酸钙溶于醋酸中 CaCO3+2H+═Ca2++H2O+CO2↑ |
某无色溶液中存在大量的H+、NH4+、SO42-,该溶液中还可能存在的离子是( )
| A、K+ |
| B、Ba2+ |
| C、OH- |
| D、HCO3- |
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )
| A、所用NaOH固体已潮解 |
| B、向容量瓶加水时,液面低于刻度线即摇匀 |
| C、定容时不小心加水超过了刻度线,用胶头滴管直接吸出多余部分 |
| D、有少量NaOH溶液残留在烧杯内 |
下列事实中,能够证明HCl是共价化合物的是( )
| A、HCl易溶于水 |
| B、液态的HCl不导电 |
| C、HCl不易分解 |
| D、HCl溶于水能电离,呈酸性 |
 八角茴香是中国传统的香料和中药,八角茴香含有一种重要成分莽草酸,莽草酸是目前世界上被证明是对抗禽流感的唯一良方“达菲”的原材料.莽草酸的结构简式为:下列关于莽草酸的说法正确的是( )
八角茴香是中国传统的香料和中药,八角茴香含有一种重要成分莽草酸,莽草酸是目前世界上被证明是对抗禽流感的唯一良方“达菲”的原材料.莽草酸的结构简式为:下列关于莽草酸的说法正确的是( )| A、该化合物的分子式为C7H11O5 |
| B、该化合物的分子处于同一平面的原子只有4个 |
| C、该化合物可以与溴水、NaOH、NaHCO3发生反应 |
| D、该化合物在浓硫酸作用下加热不能制备得到 |
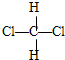 和
和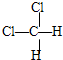 ⑦
⑦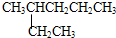 和
和