题目内容
【题目】下列关于周期表的说法正确的是( )
A.C和Si属于第ⅣA族元素,SiH4比CH4稳定
B.N和B属于第二周期元素,原子半径:N>B
C.S和Cl属于第三周期元素,其含氧酸的酸性:H2SO4<HClO3
D.某元素氢化物的化学式为RH3,则其最高价氧化物的水化物可能为HRO3
【答案】D
【解析】
![]() 同主族从上到下非金属性减弱,非金属性越强,对应氢化物越稳定,则
同主族从上到下非金属性减弱,非金属性越强,对应氢化物越稳定,则![]() 比
比![]() 稳定,故A错误;
稳定,故A错误;
B.同周期从左向右原子半径减小,则原子半径:![]() ,故B错误;
,故B错误;
C.同周期从左向右非金属性增强,非金属性越强,对应最高价含氧酸的酸性越强,则最高价含氧酸的酸性为![]() ,故C错误;
,故C错误;
D.元素氢化物的化学式为![]() ,R的最低价为
,R的最低价为![]() 价,最高价为
价,最高价为![]() 价,则最高价氧化物的水化物可能为
价,则最高价氧化物的水化物可能为![]() ,故D正确;
,故D正确;
故选D。

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
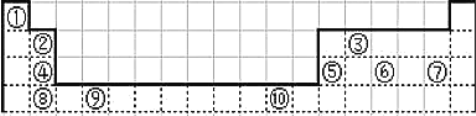
【题目】根据下表回答问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ⑤ | |||||
3 | ③ | ⑥ | |||||
4 | ④ | ⑦ | |||||
(1)表中______(填元素符号)的非金属性最强;______(填元素符号)的金属性最强,写出该元素的单质与水反应的离子方程式:______。
(2)表中元素③的原子结构示意图是______。
(3)表中元素⑤、⑦的氢化物的稳定性顺序为______>______(填化学式)。
(4)表中元素最高价氧化对应水化物中酸性最强的是______(填化学式)。