题目内容
6.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 25℃时,pH=l的盐酸溶液中,由水电离出的H+个数为10-13NA | |
| B. | 电解精炼铜时转移了NA个电子,阳极溶解 32 g铜 | |
| C. | 12.4 g白磷(P4)晶体中含有的P-P键数是0.4NA | |
| D. | 1.8g18O2分子与1.8g18O3分子中含有的氧原子数均为0.1NA |
分析 A、溶液体积不明确;
B、电解精炼铜时,阳极上溶解的不只是铜;
C、求出白磷的物质的量,然后根据白磷中含6条P-P键来分析;
D、18O2分子与18O3均由18O原子构成.
解答 解:A、溶液体积不明确,故溶液中水电离出的氢离子个数无法计算,故A错误;
B、电解精炼铜时,阳极上溶解的不只是铜,还有比铜活泼的金属,故当转移NA个电子时,阳极上溶解的质量小于32g,故B错误;
C、12.4g白磷的物质的量为0.1mol,而白磷中含6条P-P键,故0.1mol白磷中含0.6NA条P-P键,故C错误;
D、18O2分子与18O3均由18O原子构成,故1.8g18O2分子与1.8g18O3分子中含有的18O的物质的量均为0.1mol,个数均为0.1NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
16.25℃时,下列溶液中微粒的物质的量浓度关系不正确的是( )
| A. | 0.1mol•L-1NaHC2O4溶液(pH=5.5):c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) | |
| B. | 0.1mol•L-1NaHS溶液:c(OH-)+c(S2-)=c(H+)+c(H2S) | |
| C. | 0.1mol•L-1CH3COOH溶液和0.1mol•L-1CH3COONa溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
17.己知A、B、C、D为短周期元素组成的四种物质,且D为强电解质.在一定条件下有如下转化关系:A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C$\stackrel{H_{2}O}{→}$D(其他相关物质可能省略).下列说法不正确的是( )
| A. | A不可能为碳单质 | |
| B. | 若A为金属单质,则 A-定位于第三周期第IA族 | |
| C. | 若常温下D的浓溶液能使铁、铝钝化,则A可能是单质,也可能是化合物 | |
| D. | 若A是共价化合物,A的水溶液一定显碱性 |
14. 设计如图所示实验装置,夹子在实验开始时处于关闭状态,将液体A滴入烧瓶与气体B充分反应;当打开夹子后发现试管内的水立刻沸腾.则液体A和气体B的组合不可能是( )
设计如图所示实验装置,夹子在实验开始时处于关闭状态,将液体A滴入烧瓶与气体B充分反应;当打开夹子后发现试管内的水立刻沸腾.则液体A和气体B的组合不可能是( )
 设计如图所示实验装置,夹子在实验开始时处于关闭状态,将液体A滴入烧瓶与气体B充分反应;当打开夹子后发现试管内的水立刻沸腾.则液体A和气体B的组合不可能是( )
设计如图所示实验装置,夹子在实验开始时处于关闭状态,将液体A滴入烧瓶与气体B充分反应;当打开夹子后发现试管内的水立刻沸腾.则液体A和气体B的组合不可能是( )| A. | 水、氯化氢 | B. | 稀硫酸、氨气 | ||
| C. | 氢氧化钠溶液、SO2 | D. | 氢氧化钠溶液、CO |
1.下列说法错误的是( )
| A. | 石油里含有C5~C12的烷烃,可以通过石油的分馏得到汽油 | |
| B. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 | |
| C. | 重油裂化的目的主要是为了提高汽油的产量和质量 | |
| D. | 煤中含有苯和甲苯,可以通过分馏的方法将它们分离出来 |
2.一定条件下,分别对反应C(g)+CO2(g)?2CO(g)(正向吸热)进行如下操作(只改变该条件):①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO 的量.速率显著变大的是( )
| A. | ①②③④ | B. | ①②④ | C. | ①② | D. | ①③ |
6.下列图示实验操作,能达到目的是( )
| A. |  检验K+的存在 检验K+的存在 | B. | 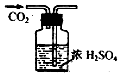 干燥CO2 | C. |  分离酒精与水 分离酒精与水 | D. |  蒸发食盐水 |

 ;
; ;
;