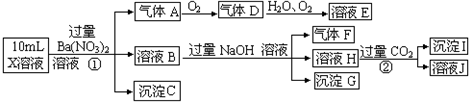
题目内容
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO+2CO
2CO2+N2.请回答下列问题:
(1)在上述条件下反应能够自发进行,则反应的△H 0(填写“>”、“<”、“=”).
(2)该反应的平衡常数表达式为 .
(3)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 .
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
①请在上表格中填入剩余的实验条件数据.
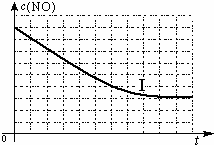
②请在给出的坐标图中,画出上表中的Ⅱ、Ⅲ两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号.
2NO+2CO
| ||
(1)在上述条件下反应能够自发进行,则反应的△H
(2)该反应的平衡常数表达式为
(3)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
| 实验编号 | T/℃ | NO初始浓度/mol?L-1 | CO初始浓度/mol?L-1 | 催化剂的比表面积/m2?g-1 |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
②请在给出的坐标图中,画出上表中的Ⅱ、Ⅲ两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号.

考点:探究温度、压强对化学反应速率的影响,化学平衡的影响因素
专题:
分析:(1)根据反应能够自发进行,则△H-T△S<0来分析该反应的焓变;
(2)根据题给方程式和平衡常数表达式的书写原则写出该反应的平衡常数表达式;
(3)能提高NO转化率则化学平衡正向移动,利用影响化学平衡移动的因素进行分析;
(4)①该实验是验证温度、催化剂比表面积对化学反应速率的影响规律,所以实验Ⅰ、Ⅱ是只改变催化剂表面积,实验Ⅱ、Ⅲ只改变温度,则物质的浓度数据相同,只有温度、接触面积两个变量;
②实验Ⅱ增大催化剂的表面积,反应速率加快,可缩短达平衡的时间,但平衡不移动,NO的平衡浓度和实验Ⅰ相同;实验Ⅲ,升高了温度,反应速率加快,可缩短达平衡的时间;该反应为放热反应,升温,平衡逆向移动,NO的平衡浓度增大,据此画出图象.
(2)根据题给方程式和平衡常数表达式的书写原则写出该反应的平衡常数表达式;
(3)能提高NO转化率则化学平衡正向移动,利用影响化学平衡移动的因素进行分析;
(4)①该实验是验证温度、催化剂比表面积对化学反应速率的影响规律,所以实验Ⅰ、Ⅱ是只改变催化剂表面积,实验Ⅱ、Ⅲ只改变温度,则物质的浓度数据相同,只有温度、接触面积两个变量;
②实验Ⅱ增大催化剂的表面积,反应速率加快,可缩短达平衡的时间,但平衡不移动,NO的平衡浓度和实验Ⅰ相同;实验Ⅲ,升高了温度,反应速率加快,可缩短达平衡的时间;该反应为放热反应,升温,平衡逆向移动,NO的平衡浓度增大,据此画出图象.
解答:
解:(1)根据题意知,该反应能够自发进行,则有△H-T△S<0,该反应正向为气体物质的量减小的反应,△S<0,该反应一定是放热才有可能自发进行,△H<0,
故答案为:<;
(2)根据平衡常数表达式的书写原则,反应2NO+2CO?2CO2+N2的平衡常数表达式为:K=
,
故答案为:K=
;
(3)A.选用更有效的催化剂,平衡不移动,NO转化率不变,故A错误;
B.该反应为放热反应,升高反应体系的温度平衡逆向移动,NO转化率减小,故B错误;
C.该反应为放热反应,降低反应体系的温度平衡正向移动,NO转化率增大,故C正确;
D.该反应正向为气体体积减小的反应,缩小容器的体积平衡正向移动,NO转化率增大,故D正确;
故答案为:CD;
(4)①实验目的为验证温度、催化剂比表面积对化学反应速率的影响规律,所以实验Ⅰ、Ⅱ应该只改变催化剂表面积,实验Ⅱ、Ⅲ中只改变温度,所以三组实验中各物质的物质的浓度数据相同,只有温度、接触面积两个变量,实验数据为:II:280、1.2×10-3、5.8×10-3;III:1.2×10-3、5.8×10-3,
故答案为:
②实验Ⅱ增大了催化剂的表面积,反应速率加快,可缩短达平衡的时间,但平衡不移动,NO的平衡浓度和实验Ⅰ相同;
实验Ⅱ、Ⅲ对比,实验Ⅲ,升高了温度,反应速率加快,可缩短达平衡的时间;
该反应为放热反应,升温,平衡逆向移动,NO的平衡浓度增大,则Ⅱ、Ⅲ两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图为: ,故答案为:
,故答案为: .
.
故答案为:<;
(2)根据平衡常数表达式的书写原则,反应2NO+2CO?2CO2+N2的平衡常数表达式为:K=
| c2(CO2)?c(N2) |
| c2(CO)?c2(NO) |
故答案为:K=
| c2(CO2)?c(N2) |
| c2(CO)?c2(NO) |
(3)A.选用更有效的催化剂,平衡不移动,NO转化率不变,故A错误;
B.该反应为放热反应,升高反应体系的温度平衡逆向移动,NO转化率减小,故B错误;
C.该反应为放热反应,降低反应体系的温度平衡正向移动,NO转化率增大,故C正确;
D.该反应正向为气体体积减小的反应,缩小容器的体积平衡正向移动,NO转化率增大,故D正确;
故答案为:CD;
(4)①实验目的为验证温度、催化剂比表面积对化学反应速率的影响规律,所以实验Ⅰ、Ⅱ应该只改变催化剂表面积,实验Ⅱ、Ⅲ中只改变温度,所以三组实验中各物质的物质的浓度数据相同,只有温度、接触面积两个变量,实验数据为:II:280、1.2×10-3、5.8×10-3;III:1.2×10-3、5.8×10-3,
故答案为:
| 实验编号 | T/℃ | NO初始浓度/mol?L-1 | CO初始浓度/mol?L-1 | 催化剂的比表面积/m2?g-1 |
| Ⅰ | ||||
| Ⅱ | 280 | 1.2×10-3 | 5.8×10-3 | |
| Ⅲ | 1.2×10-3 | 5.8×10-3 |
实验Ⅱ、Ⅲ对比,实验Ⅲ,升高了温度,反应速率加快,可缩短达平衡的时间;
该反应为放热反应,升温,平衡逆向移动,NO的平衡浓度增大,则Ⅱ、Ⅲ两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图为:
 ,故答案为:
,故答案为: .
.
点评:本题综合考查了反应速率、反应方向、化学平衡等知识,并注重考查了学生对实验化学的设计思路,同时又注重了对高考热点的考查,试题综合性较强、涉及的知识点较多,难度适中.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
下列仪器中不能用于加热的是( )
| A、试管 | B、烧杯 | C、容量瓶 | D、坩埚 |