题目内容
7.将铂丝插入KOH溶液中做电极,并在两极片分别通入氢气和氧气,形成一种燃料电池:①通氢气的铂丝为原电池的负极,发生的电极反应为H2+2OH--2e-=2H2O.②该电池工作时(放电)反应的总化学方程式为2H2+O2=2H2O.
分析 ①燃料电池中负极上是燃料发生失电子的氧化反应,从而写出电极反应式;
②氢氧燃料电池工作时的总反应方程式即是燃料燃烧的化学方程式.
解答 解:①燃料电池中负极上是燃料发生失电子的氧化反应,在碱性环境下,电极反应为:H2+2OH--2e-=2H2O,故答案为:H2+2OH--2e-=2H2O;
②氢氧燃料电池工作时的总反应方程式即是燃料燃烧的化学方程式,即2H2+O2=2H2O,故答案为:2H2+O2=2H2O.
点评 本题考查了燃料电池,燃料电池电极反应式的书写要注意结合电解质溶液书写,原料相同,电解质溶液不同,电极反应式不同,题目难度不大.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
17.下列物质中,属于强电解质的是( )
| A. | NH3•H2O | B. | H2O | C. | KOH | D. | CH3COOH |
19.将5.6g铁粉投入盛有100mL 2mol•L-1 稀硫酸的烧杯中,2min 时铁粉刚好溶解完全.如果反应前后溶液的体积不变,则该反应的平均速率可表示为( )
| A. | v(Fe)=0.5 mol•L-1•min-1 | B. | v(H2SO4)=1 mol•L-1•min-1 | ||
| C. | v(H2)=0.05 mol•L-1•min-1 | D. | v(FeSO4)=0.5 mol•L-1•min-1 |
17.下列说法中正确的是( )
| A. | 1mol•L-1的NaCl溶液是指由1mol NaCl和1000mL水配制成的溶液 | |
| B. | 从1L 0.5mol•L-1的NaCl溶液中取出100mL,剩余溶液物质的量浓度为0.45mol•L-1 | |
| C. | 标准状况下,18克H2O所含的氧原子数目为NA | |
| D. | 0℃时,2mol Cl2的体积不可能为22.4L |
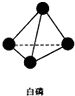 ,并指出1mol白磷(P4)含有P-P键的数目6NA
,并指出1mol白磷(P4)含有P-P键的数目6NA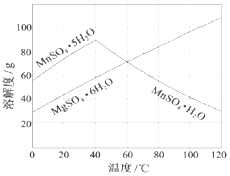 软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4
软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4