题目内容
9.下列说法中有几个是正确的( )①质子数相同的微粒一定属于同一种元素;
②在一定条件下,氧气转化为臭氧,该反应是非氧化还原反应;
③质子数相同,电子数也相同的两种微粒,可能是一种分子和一种离子;
④同位素的性质相同;
⑤一种元素只能有一种质量数;
⑥某种元素的相对原子质量取整数,就是其质量数;
⑦Cl2中35Cl与37Cl的原子个数之比与HCl中的35Cl与37Cl的原子个数之比相等.
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
分析 ①具有相同质子数的原子一定属于同种元素,但微粒可能为原子、分子、离子等;
②有元素化合价升降的是氧化还原反应;
③根据分子中质子数=电子数,而离子中质子数≠电子数,若两粒子中质子数相同,电子数肯定不同;
④同位素的物理性质不同;
⑤根据原子的质量数=质子数+中子数,而同一元素的质子数相同,中子数可能不同;
⑥原子有质量数,元素没有质量数;
⑦同位素原子在不同物质中个数之比不变.
解答 解:①具有相同质子数的原子一定属于同种元素,但微粒可能为原子、分子、离子等,如Na+、NH4+的质子数都是11,HF、Ne的质子数都是10,但不是同种元素,故①错误;
②氧气转化为臭氧没有化合价升降,是非氧化还原反应,故②正确;
③分子中质子数=电子数,而离子中质子数≠电子数,若两粒子中质子数相同,电子数肯定不同,所以质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子,故③错误;
④同位素的物理性质不同,故④错误;
⑤原子的质量数=质子数+中子数,而同一元素的质子数相同,中子数可能不同,所以同种元素的原子其质量数不一定相等,故⑤错误;
⑥元素没有质量数的概念,故⑥错误;
⑦同位素原子在不同物质中个数之比不变,所以C12中35C1与37Cl两种核素的个数之比与HC1中35Cl与37Cl的个数之比相等,故⑦正确.
故选B.
点评 本题考查化学键及化合物的分类,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,注意特殊物质中的化学键,题目难度不大.

练习册系列答案
相关题目
19.常温下,下列溶液中的微粒浓度关系正确的是( )
| A. | 常温下,c(NH4+)相等的①(NH4)2SO4 ②(NH4)2Fe(SO4)2 ③NH4Cl ④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<④<①<③ | |
| B. | 0.2mol•L-1CH3COOH溶液与0.1mol•L-1NaOH溶液等体积混合:2c(H+)-c(CH3COO-)=2c(OH-)-c(CH3COOH) | |
| C. | pH=11氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| D. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
4.下列有关胶体的应用或事实说法不正确的是( )
| A. | 将纳米碳(粒子直径为1~100nm的材料)均匀地分散到蒸馏水中,所形成的体系是胶体 | |
| B. | 氢氧化铁胶体带正电,所以进行电泳实验时,阴极区域颜色加深 | |
| C. | 可以用丁达尔效应区分氢氧化铁胶体和碘水 | |
| D. | 明矾和硫酸铁的净水原理相同 |
14.下列溶液中的Cl-的物质的量与50mL1mol•L-1 AlCl3溶液中Cl-的物质的量相等的是( )
| A. | 150mL1mol•L-1 氯化钠溶液 | B. | 75mL 1.5mol•L-1氯化钙溶液 | ||
| C. | 150mL3mol•L-1 氯化钾溶液 | D. | 75mL 1mol•L-1 氯化铁溶液 |
1.三聚氰胺是一种白色固体,分子式为C3H6N6.下列有关说法不正确的是( )
| A. | 三聚氰胺的摩尔质量为126g/mol | |
| B. | 三聚氰胺分子中各元素原子的物质的量之比为n(C):n(H):n(N)=1:2:2 | |
| C. | 三聚氰胺分子中各元素的质量比为m(C):m(H):m(N)=6:1:14 | |
| D. | 标准状况下,1mol三聚氰胺所占的体积约为22.4 L |
19.某种可降解的高分子材料(如图)的单体是( )


| A. |  | B. |  | ||
| C. |  | D. |  |
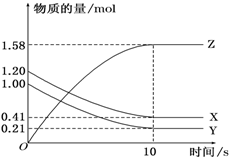 一定温度下,某1L体积固定的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,请回答下列问题:
一定温度下,某1L体积固定的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,请回答下列问题: