题目内容
下列溶液中物质的量浓度为1mol/L的是( )
| A、将40g NaOH溶解在1L水中 |
| B、将22.4L HCl气体溶于水配成1L溶液 |
| C、从1L 2mol/L的H2SO4溶液中取出0.5L |
| D、将10g NaOH溶解在少量水中,再加蒸馏水至溶液体积为250mL |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:A、40 g NaOH为1mol,溶于水配成1L溶液,浓度为1mol/L,体积是溶液的体积,不是溶剂的体积;
B、HCl所处的状态不确定,22.4LHCl气体的物质的量不一定是1mol;
C、溶液的浓度与体积无关;
D、根据n=
计算氢氧化钠的物质的量,再根据c=
计算.
B、HCl所处的状态不确定,22.4LHCl气体的物质的量不一定是1mol;
C、溶液的浓度与体积无关;
D、根据n=
| m |
| M |
| n |
| V |
解答:
解:A、40 g NaOH为1mol,溶于水配成1L溶液,浓度为1mol/L,体积1L是溶液的体积,不是溶剂的体积,故A错误;
B、HCl所处的状态不确定,22.4LHCl气体的物质的量不一定是1mol,溶于水配成1L溶液,浓度不一定是1mol/L,故B错误;
C、溶液的浓度与体积无关,从1L 2mol/L的H2SO4溶液中取出0.5L溶液的浓度仍然为2mol/L,故C错误;
D、10g NaOH的物质的量为
=0.25mol,溶液体积为250mL,故氢氧化钠溶液的浓度为
=1mol/L,故D正确;
故选D.
B、HCl所处的状态不确定,22.4LHCl气体的物质的量不一定是1mol,溶于水配成1L溶液,浓度不一定是1mol/L,故B错误;
C、溶液的浓度与体积无关,从1L 2mol/L的H2SO4溶液中取出0.5L溶液的浓度仍然为2mol/L,故C错误;
D、10g NaOH的物质的量为
| 10g |
| 40g/mol |
| 0.25mol |
| 0.25L |
故选D.
点评:本题考查学生对物质的量浓度的理解、常用化学计量的有关计算,难度不大,注意B选项为易错点,容易忽略气体摩尔体积的使用条件,注意对物质的量浓度定义式的理解.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
| A、需要加热才能发生的反应一定是吸热反应 |
| B、△H<0,△S<0的反应在任何温度下自发进行 |
| C、同一种物质不同状态时熵值大小为S(g)<S(l)<S(s) |
| D、反应物和生成物所具有的总能量决定了反应是放热还是吸热 |
下列各组溶液中离子,能在溶液中大量共存的是( )
| A、H+、Ca2+、NO3-、CO32- |
| B、K+、Na+、Cl-、NO3- |
| C、Ag+、Na+、Cl-、K+ |
| D、NH4+、K+、NO3-、SO42- |
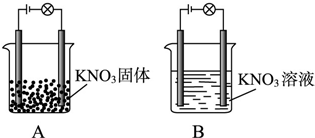 某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了.以下结论中正确的是
某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了.以下结论中正确的是( )
| A、KNO3不是电解质 |
| B、KNO3溶液是电解质 |
| C、在KNO3溶液中,水电离出了大量的离子 |
| D、在水溶液中KNO3电离出了可以自由移动的离子 |
下列说法中正确的是( )
| A、熔化状态下能导电的物质一定是离子化合物 |
| B、离子化合物不可能只含非金属元素 |
| C、离子化合物均能溶于水 |
| D、离子化合物在一定条件下可以转化成分子 |
关于0.1mol/L H2SO4溶液的叙述错误的是( )
| A、1L该溶液中含有H2SO4的质量为9.8g |
| B、0.5L该溶液中氢离子的物质的量浓度为0.2mol/L |
| C、从1L该溶液中取出100mL,则取出溶液中H2SO4的物质的量浓度为0.01mol/L |
| D、取该溶液10mL,加水稀释至100mL后H2SO4的物质的量浓度为0.01mol/L |
反应NH4HS(s)?NH3(g)+H2S(g),在某一温度下达到平衡.下列各种情况中,不能使化学平衡发生移动的是( )
| A、其他条件不变时通入SO2气体 |
| B、移走一部分NH4HS固体 |
| C、容器体积不变,充入N2 |
| D、压强不变时,充入N2 |