��Ŀ����
1�� �����������һ����;�㷺�Ļ���ԭ�ϣ��й������������£�
�����������һ����;�㷺�Ļ���ԭ�ϣ��й������������£��ٳ����£��ڸ���Ŀ������ȶ�����ˮ��ʪ����������̼��炙�̼����泥�
���۵㣺58�棬59����ɷֽ��NH3��CO2���壻
�����ܷ���ڼ�����120��-140��ʱʧˮ��������[CO��NH2��2]��
��������Һ��Ѹ�ٷֽ⣻
�ݺϳɰ��������ԭ��Ϊ��
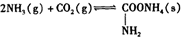
ij�о���ѧϰС�������ͼװ�ã����ںϳ�������������泥���ش��������⣺
��1������B���ƣ�����ܣ�ʢ��ҩƷ�ǣ���ʯ�ң�
��2��д��������������ܷ���ڼ�����120��-140���������صķ�Ӧ����ʽ��NH2COONH4$\frac{\underline{\;\;��\;\;}}{\;}$CO��NH2��2+H2O��
��3���ϳɰ�������淋ķ�Ӧ��һ�����������Է����У��÷�Ӧ�ķ�Ӧ�ȡ�H��0�����������=��������
��4����ͬѧ�����CO2����װ��ֱ�Ӹ��á��ɱ���������Ϊ���ĸĽ��к��ŵ㣺���ش���㣩
���������װ�ü��ڵ��»�����߲��ʣ�
��5����ʵ��װ���������Ե���ʵ��ʧ�ܵ������У���ָ����Ҫ������
�ٷ�Ӧ�����ӵ��ܹ�ϸ����ɶ�������ϡH2SO4ˮ�����ɽ��뷴Ӧ��ʹ��Ʒ������CO2�������лӷ���HClδ���������뷴Ӧ�����ᵼ��ʵ��ʧ�ܣ�
���� ��1������ͼ�κ����÷�������BΪ����ܣ����θ���ܣ��������ӵ�A�Ʊ�������֪�������B��ʢװ���Ǽ�ʯ�ң�
��2���ԱȰ�������淋Ľṹ��ʽ�����صĽṹ��ʽ��д����Ӧ����ʽ��
��3����Ӧ��һ�����������Է����У����G=��H-T��S��0�����ڡ�S��0�����ԡ�H����С��0��
��4��ʹ�øɱ�����CO2����װ�õ��ŵ��кܶ࣬��ʡȥ�˸������������ӣ�ʹ��װ�ý�Ϊ�����ڲ������ɣ�3����֪�ϳɰ�������淋ķ�ӦΪ���ȷ�Ӧ���ʸɱ�����ĵ��»��������ڰ�������淋����ɣ����öԸɱ����и��ﴦ����
��5�����ܹ�ϸ�п��ܵ��¶������������������Ʊ��Ķ�����̼�����л��е�HCl���İ�����ϡ���ᡢˮ�������뷴Ӧ��ʹ��Ʒ�����ȣ�
��� �⣺��1������BΪ����ܣ����θ���ܣ��������ӵ�A�Ʊ�������֪�������B��ʢװ���Ǽ�ʯ�ң��������ﰱ����
�ʴ�Ϊ������ܣ���ʯ�ң�
��2���ԱȰ�������淋Ľṹ��ʽ�����صĽṹ��ʽ������ԭ���غ�õ�������������ܷ���ڼ�����120��-140���������صķ�Ӧ����ʽΪ��NH2COONH4$\frac{\underline{\;\;��\;\;}}{\;}$CO��NH2��2+H2O��
�ʴ�Ϊ��NH2COONH4$\frac{\underline{\;\;��\;\;}}{\;}$CO��NH2��2+H2O��
��3����Ӧ��һ�����������Է����У����G=��H-T��S��0�����ڡ�S��0�����ԡ�H����С��0����H��0��
�ʴ�Ϊ������
��4���ɱ�����CO2����װ�õ��ŵ��кܶ࣬��ʡȥ�˸������������ӣ�ʹ��װ�ý�Ϊ�����ڲ�����������װ�ü��ɣ�3����֪�ϳɰ�������淋ķ�ӦΪ���ȷ�Ӧ���ʸɱ�����ĵ��»��������ڰ�������淋����ɣ����öԸɱ����и��ﴦ�������»�����߲��ʣ�
�ʴ�Ϊ���������װ�ü����»�����߲��ʣ�
��5����ʵ��װ�ÿ��Կ������ܹ�ϸ���п��ܵ��¶������������������Ʊ��Ķ�����̼�����л��е�HCl���İ�����ϡ���ᡢˮ�������뷴Ӧ��ʹ��Ʒ�����ȣ�
�ʴ�Ϊ���ٷ�Ӧ�����ӵ��ܹ�ϸ����ɶ�����
��ϡH2SO4ˮ�����ɽ��뷴Ӧ��ʹ��Ʒ����
��CO2�������лӷ���HClδ���������뷴Ӧ�����ᵼ��ʵ��ʧ�ܣ�
���� ���⿼����ʵ����̷��������ۣ�ʵ����Ʒ���������Ӧ�ã�����ʵ����������ͻ����ǹؼ�����Ŀ�Ѷ��еȣ�

| ��ѧʽ | CaSO4 | CaCO3 | Ca��OH��2 | CaCl2 |
| �ܽ��/g | 0.21 �� | ��0.01 | 0.077 | 74.5 |
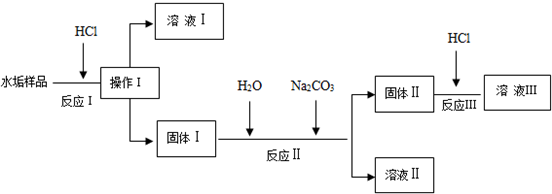
��1��������������ǹ��ˣ�
��2����Һ�����Һ���е�������HCl��CaCl2��
��3��д�����������������з��ϡ���+��=��һ����+��һ���ᡱ�����ķ�Ӧ����ʽCaCO3+2HCl=CaCl2+CO2��+H2O��
д����Ӧ������ӷ���ʽCaSO4+CO32-=CaCO3+SO42-��
��4��������������һ����Ӧ�������������ܽ�ȱ���Ƶ�B��
A����Ӧ��B����Ӧ��C����Ӧ��
��5����Һ���еĺ�������ļ��鷽���ǣ�ȡ������ҺII���ȼ������������ټ��Ȼ������ɰ�ɫ��������֤������������ӣ�
| A�� | 2 molSO2��1molO2 | B�� | 2molSO2��2molO2 | ||
| C�� | 3molSO2��1.5molO2 | D�� | 1molSO2��0.5molO2��1molSO3 |
| A�� | CaCl2 | B�� | H2O2 | C�� | K2SO4 | D�� | H2S |
| A�� | �����к�ɫ����ͭ����ͭ˿����Ҵ��У�ͭ˿�����Ϻ�ɫ | |
| B�� | C5H12�����ֲ�ͬ�Ľṹ������һ���칹���������2��3-�������� | |
| C�� | ����ƿʧȥ��ǩ����Һ��֪����������ȩ�����ᡢ�Ҵ��ͼ��ᣬ�����Ƶ�������ͭ����Һ���Խ�������Һһһ���� | |
| D�� | ��һС����Ͷ�뵽ʢ��Լ���Թ��Ҵ����Թ��У������Թܵĵײ��ḡ�𣬷ų�������ֻص��Թܵײ������ظ�ǰ������� |
| A�� | 3m+nmol | B�� | 3m+$\frac{n}{2}$mol | C�� | $\frac{3m+3p+n}{2}$mol | D�� | $\frac{3m+n}{2-3p}$mol |

| A�� | ������ӦΪAgCl+e-�TAg+Cl- | |
| B�� | �ŵ�ʱ������Ĥ�Ҳ���Һ���д�����ɫ�������� | |
| C�� | ����NaCl��Һ�������ᣬ�����ܷ�Ӧ��֮�ı� | |
| D�� | ����·��ת��0.01 mol e-ʱ������Ĥ�����Һ��Լ����0.02 mol���� |



