题目内容
2.酸式滴定管不能装的溶液是( )| A. | 稀硫酸 | B. | 氯化钠溶液 | C. | 高锰酸钾溶液 | D. | 碳酸钠溶液 |
分析 玻璃中含有二氧化硅,二氧化硅与碱性溶液反应,酸性溶液或强氧化性溶液可氧化腐蚀橡胶,则酸式滴定管不能盛装碱液,碱式滴定管不能盛装酸液或强氧化性溶液.
解答 解:A.稀硫酸为酸性溶液,可以用酸式滴定管装液,故A不选;
B.氯化钠为强酸强碱盐,溶液呈中性,可以用酸式滴定管装液,故B不选;
C.高锰酸钾溶液具有强氧化性,不能用碱式滴定管,可用酸式滴定管装液,故C不选;
D.碳酸钠为强碱弱酸盐,碳酸根离子水解CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,溶液呈碱性,酸式滴定管不能装该液体,故D选;
故选D.
点评 本题考查滴定管的使用,为高频考点,侧重分析与实验能力的考查,注意酸式滴定管不能盛装碱液,碱式滴定管不能盛装酸液或强氧化性溶液,题目难度不大.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
12.下列实验中,实验设计及所选装置合理的是( )


| A. | 回收碘的四氯化碳溶液中的四氯化碳,选① | |
| B. | 用酒精提取碘水中的碘,选③ | |
| C. | 将HCl气体从长导管通入并用水吸收,选⑤ | |
| D. | 粗盐提纯,选①和② |
13.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$ 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
| A. | 放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2 | |
| B. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-═FeO42-+4H2O | |
| C. | 充电时,蓄电池的负极应与外接电源正极相连 | |
| D. | 放电时负极附近溶液的碱性减弱 |
10.下列材料掺入普通钢中,可形成不锈钢的是( )
| A. | Ni、Cr | B. | Mn、Si | C. | 稀土金属 | D. | W、Pt |
17.工业上通过2Al2O3+3C+6Cl2$\frac{\underline{\;高温\;}}{\;}$4AlCl3+3CO2制取无水氯化铝,下列说法错误的是( )
| A. | Al2O3既不是氧化剂也不是还原剂 | B. | Cl2被还原 | ||
| C. | 每生成1 mol CO2转移2 mol电子 | D. | CO2为氧化产物 |
7.(1)已知25℃时有关弱酸的电离平衡常数:
①等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为c b d a(填序号).
②25℃时,将20mL 0.1mol•L-1 CH3COOH溶液和20mL 0.1mol•L-1 HSCN溶液分别与20mL 0.1mol•L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图1所示: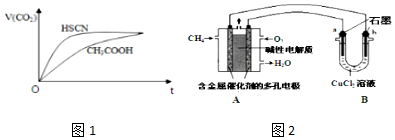
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快.
反应结束后所得两溶液中,c(CH3COO-)<c(SCN-)(填“>”、“<”或“=”)
③若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是b(填序号).
a.c(CH3COO-)b.c(H+)c.Kw d.醋酸电离平衡常数
(2)甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质.一定条件下,用甲烷可以消除氮氧化物(NOx)的污染.已知:
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H1
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g);△H2
现有一份在相同条件下对H2的相对密度为17的NO与NO2的混合气体,用16g甲烷气体催化还原该混合气体,恰好生成氮气、二氧化碳气体和水蒸气,共放出1042.8kJ热量.
①该混合气体中NO和NO2的物质的量之比为3:1
②已知上述热化学方程式中△H1=-1160kJmol,则△H2=-574 kJ/mol.
③在一定条件下NO气体可以分解为NO2气体和N2气体,写出该反应的热化学方程式4NO(g)=2NO2(g)+N2(g)△H=-293KJ/mol
(3)甲烷燃料电池可以提升能量利用率.图2是利用甲烷燃料电池电解50mL2mol/L的氯化铜溶液的装置示意图:
请回答:
①甲烷燃料电池的负极反应式是CH4-8e-+10OH-=CO32-+7H2O
②当A中消耗0.15mol氧气时,B中b极增重6.4g.
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7K2=5.6×10-11 |
②25℃时,将20mL 0.1mol•L-1 CH3COOH溶液和20mL 0.1mol•L-1 HSCN溶液分别与20mL 0.1mol•L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图1所示:

反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快.
反应结束后所得两溶液中,c(CH3COO-)<c(SCN-)(填“>”、“<”或“=”)
③若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是b(填序号).
a.c(CH3COO-)b.c(H+)c.Kw d.醋酸电离平衡常数
(2)甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质.一定条件下,用甲烷可以消除氮氧化物(NOx)的污染.已知:
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H1
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g);△H2
现有一份在相同条件下对H2的相对密度为17的NO与NO2的混合气体,用16g甲烷气体催化还原该混合气体,恰好生成氮气、二氧化碳气体和水蒸气,共放出1042.8kJ热量.
①该混合气体中NO和NO2的物质的量之比为3:1
②已知上述热化学方程式中△H1=-1160kJmol,则△H2=-574 kJ/mol.
③在一定条件下NO气体可以分解为NO2气体和N2气体,写出该反应的热化学方程式4NO(g)=2NO2(g)+N2(g)△H=-293KJ/mol
(3)甲烷燃料电池可以提升能量利用率.图2是利用甲烷燃料电池电解50mL2mol/L的氯化铜溶液的装置示意图:
请回答:
①甲烷燃料电池的负极反应式是CH4-8e-+10OH-=CO32-+7H2O
②当A中消耗0.15mol氧气时,B中b极增重6.4g.
14.下列有关性质的比较不正确的是( )
| A. | 非金属性:Cl>Br | B. | 酸性:H2SO4>H3PO4 | ||
| C. | 碱性:KOH>NaOH | D. | 热稳定性:Na2CO3<NaHCO3 |
12.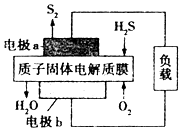 H2S废气资源利用的途径之一是回收并得到S2(g).反应原理为2H2S(g)+O2(g)═S2(g)+2H2O(1)△H=-632kJ•mol-1.如图所示为H2S燃料电池的结构示意图.下列说法正确的是( )
H2S废气资源利用的途径之一是回收并得到S2(g).反应原理为2H2S(g)+O2(g)═S2(g)+2H2O(1)△H=-632kJ•mol-1.如图所示为H2S燃料电池的结构示意图.下列说法正确的是( )
 H2S废气资源利用的途径之一是回收并得到S2(g).反应原理为2H2S(g)+O2(g)═S2(g)+2H2O(1)△H=-632kJ•mol-1.如图所示为H2S燃料电池的结构示意图.下列说法正确的是( )
H2S废气资源利用的途径之一是回收并得到S2(g).反应原理为2H2S(g)+O2(g)═S2(g)+2H2O(1)△H=-632kJ•mol-1.如图所示为H2S燃料电池的结构示意图.下列说法正确的是( )| A. | 电池工作时,电子从电极a经质子固体电解质膜流向电极b | |
| B. | 电极a上发生的电极反应为2H2S+4OH--4e-═S2+4H2O | |
| C. | 当电路中通过2 mol电子时,有2 mol H+经质子固体电解质膜进入正极区 | |
| D. | 当反应中生成64 g S2时,电池内部有632KJ的能量转化为电能 |
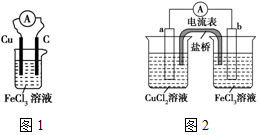 实验室有如下材料:铜片、铁片、石墨棒、CuCl2溶液、FeCl3溶液、导线、电流表、盐桥(装有琼脂-KCl的U形管)、烧杯等.甲同学设计了如图1的原电池装置,但乙同学发现甲同学设计的原电池装置效率不高,电流在短时间内就会衰减,为解决以上问题,将原电池设计成了带盐桥的装置,如图2所示.
实验室有如下材料:铜片、铁片、石墨棒、CuCl2溶液、FeCl3溶液、导线、电流表、盐桥(装有琼脂-KCl的U形管)、烧杯等.甲同学设计了如图1的原电池装置,但乙同学发现甲同学设计的原电池装置效率不高,电流在短时间内就会衰减,为解决以上问题,将原电池设计成了带盐桥的装置,如图2所示.