题目内容
15.标准状况下,将336L的NH3溶于1L水中,得到密度为ag/cm3的溶液(1)列式并计算所得溶液的溶质质量分数;(不要求写出解答过程)
(2)列式并计算所得溶液的物质的量浓度;(不要求写出解答过程)
(3)将上述氨水全部转化为NH4Cl,所需2mol/L的盐酸的体积为7.5L(已知 NH3+HCl=NH4C1)
分析 根据n=$\frac{V}{{V}_{m}}$计算氨气物质的量,根据m=nM计算氨气质量,标况下336L氨气物质的量为$\frac{336L}{22.4L/mol}$=15mol,1L水的质量为1000g;
(1)溶液中溶质质量分数=$\frac{溶质质量}{溶质质量+溶剂质量}$×100%;
(2)根据V=$\frac{m}{ρ}$计算溶液体积,再根据c=$\frac{n}{V}$计算溶液物质的量浓度;
(3)由NH3+HCl=NH4C1,可知n(HCl)=n(NH3),再根据V=$\frac{n}{c}$计算.
解答 解:根据n=$\frac{V}{{V}_{m}}$计算氨气物质的量,根据m=nM计算氨气质量,标况下336L氨气物质的量为$\frac{336L}{22.4L/mol}$=15mol,1L水的质量为1000g;
(1)溶液中溶质质量分数=$\frac{\frac{336L}{22.4L/mol}×17g/mol}{\frac{336L}{22.4L/mol}×17g/mol+1000g}$×100%=20.3%,
答:溶液质量分数为20.3%;
(2)该溶液物质的量浓度=$\frac{\frac{336L}{22.4L/mol}}{\frac{1000g+\frac{336L}{22.4L/mol}×17g/mol}{1000ag/c{m}^{3}}}$=11.95a mol/L,
答:该溶液物质的量浓度为11.95a mol/L;
(3)由NH3+HCl=NH4C1,可知n(HCl)=n(NH3)=$\frac{336L}{22.4L/mol}$=15mol,需要盐酸体积为$\frac{15mol}{2mol/L}$=7.5L,
故答案为:7.5L.
点评 本题考查溶液浓度有关计算,涉及质量分数、物质的量浓度,注意对定义式的理解掌握.

| A. | 在密闭容器中加入1molN2和3molH2充分反应可得到NH3分子数为2NA | |
| B. | 20 g重水(D2O)中含有的电子数为10NA | |
| C. | 粗铜电解精炼时,阳极质量减少6.4 g,则转移电子数一定是0.2NA | |
| D. | 235g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n净产生的中子(${\;}_{0}^{1}$n)数为10NA |
| A. | 若甲为Fe,则丁可能是Cl2 | B. | 若甲为焦炭,则丁可能是O2 | ||
| C. | 若甲为SO2,则丁可能是氨水 | D. | 若甲为NaOH 溶液,则丁可能是CO2 |
(1)氨基甲酸铵(NH2COONH4)分解反应是NH2COONH4(s)?2NH3(g)+CO2(g).
①某物质的标准摩尔生成焓是指在标准状态下由稳定单质生成1mol该物质时的反应焓变.
例如:CH3COOH的标准摩尔生成焓是指如下反应在标准状态下的焓变△H(CH3COOH)C(s)+O2(g)+H2(g)═CH3COOH(l)△H(CH3COOH)
已知NH2COONH4(s)、NH3(g)和CO2(g)的标准摩尔生成焓分别为△H1、△H2和△H3,则上述NH2COONH4分解反应的反应热△H=2△H2+△H3-△H1
②将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
ii.根据表中数据,列式计算25.0℃时的分解平衡常数:1.6×10-8.(保留两位有效数字)
iii.取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.下列说法正确的是c.
a、恒温、压缩容器体积,再次达到平衡后,容器内的压强大于原平衡压强
b、恒温、增大容器体积,再次达到平衡后,容器内的c(CO2)小于原平衡时的浓度
c、固定活塞、升高温度,再次达到平衡后,容器内的压强大于原平衡时的压强.
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
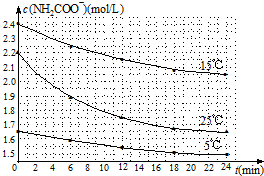
①计算25℃时,0~6min氨基甲酸铵水解反应的平均速率0.05mol/(L•min).
②根据图中信息,如何说明水解反应速率随温度升高而增大:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
| A. | 标准状况下,22.4LCH4中含有氢原子数目为4NA | |
| B. | 1molNa2O2中含有的阴离子和阳离子的数目为2NA | |
| C. | 0.1mol/LCu(NO3)2溶液中含有的NO3-数目为0.2NA | |
| D. | 28gN2中所含的原子数目为NA |
| A. | CH2=CH-CH3 | B. | C6H5-CH=CH2 | C. | C6H5-CH3 | D. | CH2=CH2 |
| 选项 | 叙述I | 叙述II |
| A | 用酸度计测定SO2和CO2饱和溶液的pH,前者pH小 | 结论:说明H2SO3酸性强于H2CO3 |
| B | SiO2是酸性氧化物 | SiO2不与任何酸溶液反应 |
| C | 配制SnCl2溶液时,先将SnCl2溶于适量的稀盐酸中,再用蒸馏水稀释,保存时再在试剂瓶中加入少量的锡粒 | 抑制Sn2+水解,并防止Sn2+被氧化为Sn4+ |
| D | 浓硝酸具有强氧化性 | 应保存在棕色玻璃试剂瓶中 |
| A. | A | B. | B | C. | C | D. | D |
