题目内容
8.下列物质中:①HClO ②苛性钠 ③铁 ④乙醇 ⑤氨水 ⑥H2SO4 ⑦水 ⑧硫酸钡 ⑨二氧化碳属于电解质的是(填序号,下同)①②⑥⑦⑧,
属于强电解质的是②⑥⑧,
属于非电解质的是④⑨,
既不属于电解质也不属于非电解质的是③⑤.
分析 在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里和熔融状态下都不导电的化合物是非电解质;完全电离的属于强电解质,部分电离的为弱电解质,据此解答即可.
解答 解:①HClO为弱酸,在水溶液中部分电离,属于弱电解质
②苛性钠为强碱,熔融状态和溶于水中均能完全电离,属于强电解质;
③铁为金属单质,既不是电解质也不是非电解质;
④乙醇不能电离,属于非电解质;
⑤氨水属于混合物,既不是电解质也不是非电解质;
⑥H2SO4 溶于水完全电离,为强酸,属于强电解质;
⑦水微弱电离,属于弱电解质;
⑧硫酸钡熔融状态下完全电离,属于强电解质;
⑨二氧化碳不能电离,属于非电解质;
故答案为:①②⑥⑦⑧; ②⑥⑧;④⑨;③⑤.
点评 本题主要考查的是电解质与非电解质的概念、强电解质与弱电解质的概念,注意单质和混合物既不是电解质也不是非电解质,难度不大.

练习册系列答案
相关题目
19.下列各离子浓度的大小比较,正确的是( )
| A. | 同浓度下列溶液中:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl④NH3•H2O,c(NH4+)由大到小的顺序是:①>③>②>④ | |
| B. | 常温时,将等体积的盐酸和氨水混合后,pH=7,则c (NH4+)>c (Cl-) | |
| C. | 0.2 mol•L-1Na2CO3溶液中:c (OH-)=c (HCO3-)+c (H+)+c (H2CO3) | |
| D. | 0.01 mol•L-1的NH4Cl溶液与0.05mol•L-1的NaOH溶液等体积混合:c (Cl-)>c (NH4+)>c (Na+)>c (OH-)>c (H+) |
3.已知金刚石和石墨在氧气中完全燃烧的热化学方程式如下:①C(金刚石,s)+O2(g)=CO2(g)△H1=-395.41kJ/mol;②C(石墨,s)+O2(g)=CO2(g)△H2=-393.51kJ/mol.关于金刚石与石墨的转化,下列说法正确的是( )
| A. | 金刚石转化成石墨是自发进行的过程 | |
| B. | 石墨转化成金刚石是自发进行的过程 | |
| C. | 石墨和金刚石能量一样高 | |
| D. | 金刚石比石墨能量低 |
20.下列物质属于纯净物的是( )
| A. | 浮有冰块的水 | B. | 食盐水 | C. | 洁净的空气 | D. | 纯盐酸 |
17.下列关于1.5mol 氢气的叙述中,错误的是( )
| A. | 质量是4g | B. | 标准状况下的体积约为33.6L | ||
| C. | 电子数是3mol | D. | 分子数是9.03×1023 个 |
18.一定条件下用甲烷可以消除氮氧化物(NOx)的污染.已知:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1
下列叙述正确的是( )
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1
下列叙述正确的是( )
| A. | CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(l)△H=-867 kJ•mol-1 | |
| B. | CH4催化还原NOx为N2的过程中,若x=1.6,则转移电子3.2 mol | |
| C. | 若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ | |
| D. | 若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移电子3.2 mol |
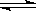 3C(g)+2D(s) △H>0。达到平衡时生成
3C(g)+2D(s) △H>0。达到平衡时生成 了1.8 mol C。
了1.8 mol C。
 .
.