题目内容
3.下列说法中,正确的是( )| A. | SO2能使品红溶液、酸性KMnO4溶液褪色 | |
| B. | 可以用澄清石灰水来鉴别SO2与CO2 | |
| C. | 硫粉在过量的纯氧中燃烧可以生成SO3 | |
| D. | SO2能使溴水褪色,体现SO2的漂白性 |
分析 A.依据二氧化硫的漂白性,还原性解答;
B.二氧化硫、二氧化碳都是酸性氧化物,都能与氢氧化钙反应先生成沉淀后沉淀溶解;
C.硫与氧气反应生成二氧化硫;
D.依据二氧化硫与溴水反应中硫元素化合价变化解答.
解答 解:A.二氧化硫的漂白性,能够漂白品红使品红褪色,具有还原性,能够还原酸性高锰酸钾,使其褪色,故A正确;
B.二氧化硫、二氧化碳都是酸性氧化物,都能与氢氧化钙反应先生成沉淀后沉淀溶解,二者现象相同,所以不能用澄清石灰水来鉴别SO2与CO2,故B错误;
C.硫粉在过量的纯氧中燃烧可以生成SO2,得不到三氧化硫,故C错误;
D.二氧化硫与溴水发生氧化还原反应,二氧化硫中+4价硫化合价升高为硫酸中+6价,被氧化,体现二氧化硫的还原性,故D错误;
故选:A.
点评 本题考查了元素化合物知识,熟悉二氧化硫漂白性、还原性、酸性氧化物的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
14.下列关于反应能量的说法正确的是( )
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H<0,反应物总能量>生成物总能量 | |
| B. | 相同条件下1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
11.从柑桔中炼制萜二烯 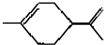 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )
 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )| A. | 能使酸性高锰酸钾溶液褪色 | |
| B. | 常温下为气态,难溶于水 | |
| C. | 分子式为C10H18 | |
| D. | 与过量的溴的CCl4溶液反应后产物为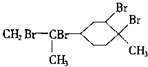 |
18.下列反应都是中学阶段常见的反应,从分类的角度选出不同类型的( )
| A. | 皂化反应 | B. | 焰色反应 | C. | 水解反应 | D. | 钝化反应 |
8.表为元素周期表的一部分.
(1)表中元素F的非金属性最强;元素K的金属性最强;元素Br的单质室温下呈液态(填写元素符号.
(2)表中元素②⑥⑩氢化物的稳定性最强的是:HF (填写化学式,下同),最高价氧化物对应水化物的酸性最强的是:HClO4;
(3)表中元素①③⑧最高价氧化物对应水化物的碱性最强的是:KOH;
(4)表中元素③⑤⑦最高价氧化物对应水化物两两反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O、H++OH-=H2O、Al(OH)3+3H+=Al3++3H2O.
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 二 | ① | ② | |||||
| 三 | ③ | ④ | ⑤ | ⑦ | ⑥ | ||
| 四 | ⑧ | ⑨ | ⑩ |
(2)表中元素②⑥⑩氢化物的稳定性最强的是:HF (填写化学式,下同),最高价氧化物对应水化物的酸性最强的是:HClO4;
(3)表中元素①③⑧最高价氧化物对应水化物的碱性最强的是:KOH;
(4)表中元素③⑤⑦最高价氧化物对应水化物两两反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O、H++OH-=H2O、Al(OH)3+3H+=Al3++3H2O.
15.化学与生产生活紧密相关,下列说法正确的是( )
| A. | Na2O2是碱性氧化物,可用于杀菌消毒和供氧剂 | |
| B. | 高纯度单质硅有良好的半导体性能,可用于制备光电池 | |
| C. | 氨气是一种碱性气体,可用碱石灰或CaCl2干燥 | |
| D. | SO2和Cl2都能使品红溶液褪色,两者等体积混合可以增强漂白能力 |
12.能够说明一个可逆反应H2(g)+I2(g)?2HI(g)已达到平衡状态的是( )
| A. | 1 mol H-H键断裂的同时有1 mol H-I键形成 | |
| B. | 1 mol H-H键断裂的同时有2 mol H-I键形成 | |
| C. | 1 mol I-I键断裂的同时有2 mol H--I键形成 | |
| D. | 1 mol H-H键断裂的同时有1 mol I-I键形成 |