题目内容
14.(1)对下列有机物进行系统命名①
 2-甲基-6-乙基壬烷
2-甲基-6-乙基壬烷②
 4,7,7-三甲基-1-辛烯
4,7,7-三甲基-1-辛烯(2)写出下列有机物的结构简式
①2,6-二甲基-4-乙基辛烷:CH3CH(CH3)CH2CH(CH2CH3)CH2CH(CH3)CH2CH3;
②2,4-二甲基-2,4-己二烯:C(CH3)2=CHC(CH3)=CHCH3;
③2,3,3-三甲基戊烷:CH3CH(CH3)C(CH3)2CH2CH3.
分析 (1)①烷烃命名时,要选最长的碳链为主链,从离支链近的一端给主链上的碳原子编号,表示出支链的位置;
②烯烃命名时,要选含官能团的最长碳链为主链,从离官能团近的一端给主链上的碳原子进行编号,用双键两端编号较小的碳原子表示出双键的位置;
(2)①最长的主链含有8个C原子,甲基处于2、6号碳原子上,乙基处于4号碳原子上,据此书写;
②2,4-二甲基-2,4-己二烯,主链为2,4-己二烯,在2号C、4号C上都含有一个甲基,编号从距离碳碳双键最近的一端开始;
③该有机物为烷烃,主链为戊烷,根据烷烃的命名原则写出该有机物的结构简式.
解答 解:(1)①烷烃命名时,要选最长的碳链为主链,故主链上有9个碳原子,为壬烷,从离支链近的一端给主链上的碳原子编号,则在2号碳上有一个甲基,在6号碳原子上有一个乙基,则名称为2-甲基-6-乙基壬烷,故答案为:2-甲基-6-乙基壬烷;
②烯烃命名时,要选含官能团的最长碳链为主链,则主链上有8个碳原子,为辛烯,从离官能团近的一端给主链上的碳原子进行编号,则双键位于1号和2号碳原子之间,在4号碳原子上有一个甲基,在7号碳原子上有两个甲基,用双键两端编号较小的碳原子表示出双键的位置,则名称为:4,7,7-三甲基-1-辛烯,故答案为:4,7,7-三甲基-1-辛烯;
(2)①2,6-二甲基-4-乙基辛烷中最长的主链含有8个C原子,甲基处于2、6号碳原子上,乙基处于4号碳原子上,其结构简式为CH3CH(CH3)CH2CH(CH2CH3)CH2CH(CH3)CH2CH3,故答案为:CH3CH(CH3)CH2CH(CH2CH3)CH2CH(CH3)CH2CH3;
②2,4-二甲基-2,4-己二烯,主链为2,4-己二烯,在2号C、4号C上都含有一个甲基,编号从距离碳碳双键最近的一端开始,该有机物结构简式为:C(CH3)2=CHCH=C(CH3)2,故答案为:C(CH3)2=CHC(CH3)=CHCH3;
③2,3,3-三甲基戊烷:主链为戊烷,在2、3、3号C各含有1个甲基,该有机物的结构简式为:CH3CH(CH3)C(CH3)2CH2CH3,
故答案为:CH3CH(CH3)C(CH3)2CH2CH3.
点评 本题考查了有机物的结构简式书写及命名,题目难度不大,一般要求了解烷烃的命名、苯的同系物的命名及简单的烃的衍生物的命名,试题有利于培养学生规范答题能力.

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案| A. | 离子半径:c>b>a | |
| B. | a与c形成化合物的溶液有毒,要密封保存于玻璃瓶中 | |
| C. | a2b2与d的一种较高价态离子的盐溶液混合时会产生大量的b2 | |
| D. | d高价离子在溶液中与c的低价离子因发生氧化还原反应而不能大量共存 |
| A. | 使用填埋法处理未经分类的生活垃圾 | |
| B. | “地沟油”经过加工处理后可用来制肥皂 | |
| C. | 大量使用薪柴为燃料,践行低碳生活 | |
| D. | CO2、NO2或SO2的排放是形成酸雨的主要原因 |
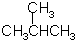 的名称是( )
的名称是( )| A. | 2-甲基丁烷 | B. | 2-甲基丙烷 | C. | 1,1-二甲基乙烷 | D. | 三甲基甲烷 |
| A. | 根据反应Cu+H2SO4$\frac{\underline{\;电解\;}}{\;}$CuSO4+H2↑可推出Cu的还原性比H2的强 | |
| B. | 因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 | |
| C. | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色,证明氧化性:H2O2比Fe3+强 | |
| D. | 在2Na+2C+2NH3=2NaCN+3H2↑反应中的还原剂为C和Na |

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2[ | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
(2)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有漏斗、烧杯、玻璃棒.
(3)在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4.当pH=5时,溶液中c(Fe3+)=2.6×10-12 mol•L-1.(常温下Ksp[Fe(OH)3]=2.6×10-39).检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe3+沉淀完全.
(4)加入Zn粉的作用是除去溶液中的Cu2+.“操作A”的名称是冷却.
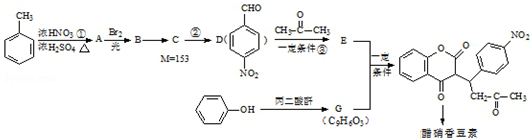
 +H2O
+H2O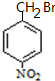 G
G
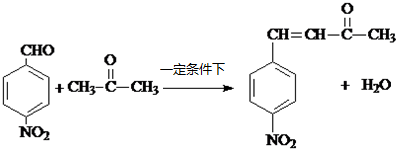
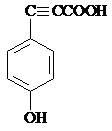 .
.