题目内容
11.下列各组离子,在溶液中能大量共存,加入H2SO4溶液后既有气体放出又有沉淀生成的一组是( )| A. | Ba2+、NO3-、NH4+、Cl- | B. | Ba2+、HCO3-、NH4+、NO3- | ||
| C. | K+、Cu2+、Cl-、OH- | D. | Na+、CO32-、SO42-、K+ |
分析 A.加入硫酸后有BaSO4沉淀生成,但无气体放出;
B.四种离子之间能够共存,加入硫酸后,生成硫酸钡沉淀,放出CO2气体;
C.铁离子与氢氧根离子反应生成难溶物氢氧化铜;
D.加入硫酸后放出CO2气体,但无沉淀生成.
解答 解:A.Ba2+、NO3-、NH4+、Cl-之间不发生反应,但是加入硫酸后有BaSO4沉淀生成,但无气体放出,不满足条件,故A错误;
B.Ba2+、HCO3-、NH4+、NO3-之间不发生反应,加入硫酸后,生成硫酸钡沉淀,放出CO2气体,满足条件,故B正确;
C.OH-与Cu2+会结合生成Cu(OH)2沉淀,不能共存,故C错误;
D.Na+、CO32-、SO42-、K+之间不反应,加入硫酸后放出CO2气体,但无沉淀生成,不满足条件,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.已知氯化碘(ICl)的性质类似于卤素,有很强的化学活性.ICl跟Zn,H2O分别发生如下反应:2ICl+2Zn=ZnCl2+ZnI2,ICl+H2O=HCl+HIO.下列说法正确的是( )
| A. | 在Zn跟ICl的反应中,ZnI2既是氧化产物又是还原产物 | |
| B. | 在Zn跟ICl的反应中,ZnCl2既不是氧化产物又不是还原产物 | |
| C. | 在H2O跟ICl的反应中,ICl 既是氧化剂又是还原剂 | |
| D. | 在H2O跟ICl的反应中,ICl是氧化剂 |
19.下列氯化物中,不能用单质跟氯气直接反应制得的是( )
| A. | NaC1 | B. | HCI | C. | FeCl2 | D. | CuCl2 |
16.取Xg镁和铝的混合物,向其中加入适量的稀盐酸,恰好完全反应生成标准状况下的气体BL向反应后的溶液中加入VmLCmol/L氢氧化钠溶液,使金属离子刚好沉淀完全,得到的沉淀质量为Yg.再将得到的沉淀灼烧至质量不再改变为止,得到固体Pg.则下列关系不正确的是( )
| A. | $\frac{5}{3}$X<P<$\frac{17}{9}$X | B. | P=X+$\frac{V•C}{12.5}$ | C. | Y=X+V•C | D. | C=$\frac{1000B}{11.2V}$ |
3.五种短周期元素在元素周期表中的相对位置如表所示,其中E的非金属性在同周期元素中最强,下列说法正确的是( )
| A | B | |||
| C | D | E |
| A. | 简单离子的半径:D>E>C>B | |
| B. | 氧化物对应的水化物的酸性:E-定强于D | |
| C. | B、D分别与氢元素形成的化合物的沸点:D>B | |
| D. | A的最高价氧化物的水化物能与A的氢化物反应生成离子化合物 |
20.中华民族有着光辉灿烂的发明史,下列发明创造不涉及氧化还原反应的是( )
| A. | 用胆矾炼铜 | B. | 用铁矿石炼铁 | ||
| C. | 黑火药的使用 | D. | 打磨磁石制指南针 |
1.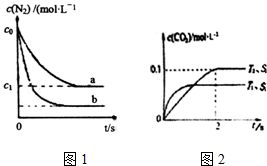 汽车尾气是城市主要空气污染物,研究控制汽车尾气排放是保护环境的首要任务.
汽车尾气是城市主要空气污染物,研究控制汽车尾气排放是保护环境的首要任务.
(1)汽车内燃机工作时发生反应N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.T0℃时将等物质的量的N2(g)和O2(g)充入恒容密闭容器中发生反应,图1曲线a表示该反应在T0℃下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化.下列叙述正确的是ad.
a.温度T0℃下,该反应的平衡常数K=$\frac{4({c}_{0}-{c}_{1})^{2}}{{{c}_{1}}^{2}}$
b.温度T0℃下,随着反应的进行,混合气体的密度减小
c.曲线b对应的条件改变可能是充入了NO气体
d.若曲b对应的条件改变是温度,可判断△H>0
(2)汽车安装尾气催化转化器可将尾气中的主要污染物转化成无毒物质,反应为:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H.某科研小组为了探究催化剂的效果,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
①2~3s间的平均反应速率v(N2)=4.5×10-5mol•L-1•S1.
②在该温度下,反应的平衡常数K=5000.
③在使用等质量催化剂时,增大固体催化剂的表面积可提高化学反应速率.下图表示在其他条件不变时,CO2的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.由此可知该反应的△H<0(填“>”“<”),原因是温度T1到达平衡的时间短,反应速率快,故温度T2<T1,温度越高,平衡时CO2的浓度越低,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0.
若催化剂的表面积S1>S2,在图2中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线.
④假设在密闭容器中发生上述反应,达到平衡时能提高NO转化率的措施是降低反应体系的温度或缩小容器的体积.
(3)用NH3还原NOx生成N2和H2O也可以减少污染.现有NO、NO2的混合气3L,可用同温同压下3.5L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为1:3.
 汽车尾气是城市主要空气污染物,研究控制汽车尾气排放是保护环境的首要任务.
汽车尾气是城市主要空气污染物,研究控制汽车尾气排放是保护环境的首要任务.(1)汽车内燃机工作时发生反应N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.T0℃时将等物质的量的N2(g)和O2(g)充入恒容密闭容器中发生反应,图1曲线a表示该反应在T0℃下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化.下列叙述正确的是ad.
a.温度T0℃下,该反应的平衡常数K=$\frac{4({c}_{0}-{c}_{1})^{2}}{{{c}_{1}}^{2}}$
b.温度T0℃下,随着反应的进行,混合气体的密度减小
c.曲线b对应的条件改变可能是充入了NO气体
d.若曲b对应的条件改变是温度,可判断△H>0
(2)汽车安装尾气催化转化器可将尾气中的主要污染物转化成无毒物质,反应为:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H.某科研小组为了探究催化剂的效果,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(×10-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.60 | 1.00 | 1.00 |
| c(CO)/(×10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.76 | 2.70 | 2.70 |
②在该温度下,反应的平衡常数K=5000.
③在使用等质量催化剂时,增大固体催化剂的表面积可提高化学反应速率.下图表示在其他条件不变时,CO2的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.由此可知该反应的△H<0(填“>”“<”),原因是温度T1到达平衡的时间短,反应速率快,故温度T2<T1,温度越高,平衡时CO2的浓度越低,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0.
若催化剂的表面积S1>S2,在图2中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线.
④假设在密闭容器中发生上述反应,达到平衡时能提高NO转化率的措施是降低反应体系的温度或缩小容器的体积.
(3)用NH3还原NOx生成N2和H2O也可以减少污染.现有NO、NO2的混合气3L,可用同温同压下3.5L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为1:3.