题目内容
5.下列判断不合理的是( )| A. | NH3的水溶液能导电,因此NH3是电解质 | |
| B. | 焰色反应是物理变化 | |
| C. | 碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 | |
| D. | 蔗糖、碳酸钡和水分别属于非电解质、强电解质和弱电解质 |
分析 A.氨水导电的两种不是氨气电离的,氨气为非电解质;
B.焰色反应是金属元素的一种性质,是某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特征的颜色的反应,反应中没有新物质生成;
C.与酸反应只生成盐和水的反应为碱性氧化物,碱性氧化物一定为金属氧化物,而金属氧化物不一定为碱性氧化物,如过氧化钠不属于碱性氧化物;
D.根据电解质与非电解质、强电解质与弱电解质的概念进行判断.
解答 解:A.NH3的水溶液能导电,是一水合氨电离出的离子,氨气不电离,则NH3不是电解质,故A错误;
B.焰色反应是金属元素的一种性质,是某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特征的颜色的反应,反应中没有新物质生成,则焰色反应是物理变化,故B正确;
C.碱性氧化物对应的水化物为碱,所以碱性氧化物一定是金属氧化物,而金属氧化物不一定是碱性氧化物,如过氧化钠为金属氧化物,但是过氧化钠不属于碱性氧化物,故C正确;
D.蔗糖在水溶液和熔融状态下都不导电,蔗糖为非电解质;硫酸钡在熔融状态下能够完全电离,属于电解质;水能够部分电离出氢离子和氢氧根离子,水为弱电解质,故D正确;
故选A.
点评 本题考查了电解质与非电解质、强电解质与弱电解质的判断、焰色反应、金属氧化物等知识,题目难度不大,试题涉及的知识点较多,注意明确焰色反应实质、电解质与非电解质的区别,试题充分考查了学生对学生知识的掌握情况.

练习册系列答案
相关题目
15.化学元素家族又添新成员,113号元素Uut和115号元素Uup.已知113号元素的一种核素为${\;}_{113}^{278}$Uut,下列说法中正确的是( )
| A. | 113号元素的相对原子质量为278 | |
| B. | 115号元素可显+5价 | |
| C. | ${\;}_{113}^{278}$Uut的中子数与电子数之差为165 | |
| D. | 两种元素均位于周期表第八周期 |
16.下列关于煤、石油和天然气及其相关产品的叙述错误的是( )
| A. | 液化天然气(LNG)和罐装液化石油气(LPG)主要成分都属于烃类 | |
| B. | 煤经过干馏可以得到焦炭和煤焦油等产品,分馏煤焦油可以获得多种芳香烃 | |
| C. | 石油裂化的主要目的是提高轻质液体燃料的产量和质量 | |
| D. | 石油的分馏、煤的液化、煤的气化属于物理变化 |
20.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使pH试纸显深蓝色的溶液:Na+、K+、I-、NO${\;}_{3}^{-}$ | |
| B. | 0.1mol•L-1的Ca(ClO)2溶液:K+、Na+、I-、Cl- | |
| C. | 能使甲基橙显红色的溶液:K+、Fe2+、Cl-、NO${\;}_{3}^{-}$ | |
| D. | 加KSCN显红色的溶液:Na+、Mg2+、I-、SO${\;}_{4}^{2-}$ |
10.不能和镁发生反应的是( )
| A. | OH- | B. | H+ | C. | Ag+ | D. | 氯水 |
7. 四种短周期元素在周期表中的相对位置如下所示,其中Y元素原子最外层电子数是其电子层数的3倍.
四种短周期元素在周期表中的相对位置如下所示,其中Y元素原子最外层电子数是其电子层数的3倍.
请回答下列问题:
(1)元素W的最高价氧化物对应的水化物的化学式为HClO4;
(2)这些元素的氢化物中,水溶液碱性最强的化合物是NH3.H2O或NH3(写化学式);
(3)X、Y、Z、W形成的简单阴离子半径大小顺序为S2->Cl->N3->O2-(用离子符号填空);证明W的非金属性比强Z的最简单方法是H2S+Cl2=S+2HCl(用化学方程式填空);
(4)Z的低价氧化物通入W的单质形成的水溶液中反应的化学方程式:SO2+Cl2+2H2O=H2SO4+2HCl;
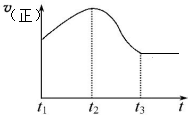
(5)Z的低价氧化物能与Y的单质在一定体积的密闭容器反应,该反应属于可逆反应(填“可逆反应”或“非可逆反应”),反应速率与时间关系如图所示,t1到t2反应速率逐渐加快的原因是浓度变化不明显,反应放热,温度升高,反应速率加快,在t3(填“t1”“t2”或“t3”)时达到平衡;对该反应,下列说法正确的是AC.
A.Y的单质是氧化剂
B.混合气体的密度不再改变,可以判断反应达到平衡状态
C.Z的低价氧化物能使品红褪色
D.反应达到平衡状态时,反应停止
(6)将一定量的W单质通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaW、NaWO、NaWO3共存体系,则消耗的W单质的物质的量为0.15mol.
 四种短周期元素在周期表中的相对位置如下所示,其中Y元素原子最外层电子数是其电子层数的3倍.
四种短周期元素在周期表中的相对位置如下所示,其中Y元素原子最外层电子数是其电子层数的3倍.| X | Y | |
| Z | W |
(1)元素W的最高价氧化物对应的水化物的化学式为HClO4;
(2)这些元素的氢化物中,水溶液碱性最强的化合物是NH3.H2O或NH3(写化学式);
(3)X、Y、Z、W形成的简单阴离子半径大小顺序为S2->Cl->N3->O2-(用离子符号填空);证明W的非金属性比强Z的最简单方法是H2S+Cl2=S+2HCl(用化学方程式填空);
(4)Z的低价氧化物通入W的单质形成的水溶液中反应的化学方程式:SO2+Cl2+2H2O=H2SO4+2HCl;
(5)Z的低价氧化物能与Y的单质在一定体积的密闭容器反应,该反应属于可逆反应(填“可逆反应”或“非可逆反应”),反应速率与时间关系如图所示,t1到t2反应速率逐渐加快的原因是浓度变化不明显,反应放热,温度升高,反应速率加快,在t3(填“t1”“t2”或“t3”)时达到平衡;对该反应,下列说法正确的是AC.
A.Y的单质是氧化剂
B.混合气体的密度不再改变,可以判断反应达到平衡状态
C.Z的低价氧化物能使品红褪色
D.反应达到平衡状态时,反应停止
(6)将一定量的W单质通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaW、NaWO、NaWO3共存体系,则消耗的W单质的物质的量为0.15mol.
4.下列混合物适合用过滤的方法进行分离的是( )
| A. | 糖中混有少量食盐 | B. | 氯化钠中混有少量泥沙 | ||
| C. | 食盐中混有少量硝酸钾 | D. | 水中混有酒精 |
5.下列各组既不是同系物,又不是同分异构体的是( )
| A. | 乙烯和2-丁烯 | B. | 苯和乙炔 | ||
| C. | 1-氯丙烷和2-氯丙烷 | D. | 异丁烷和正戊烷 |