题目内容
8.11.9g金属锡跟100mL12mol•L-1HNO3共热一段时间.完全反应后测定溶液中c(H+)为8mol•L-1,溶液体积仍为100mL.放出的气体在标准状况下体积约为8.96L.由此推断氧化产物可能是(Sn的相对原子质量为119)( )| A. | Sn(NO3)4 | B. | Sn(NO3)2 | C. | SnO2?4H2O | D. | SnO |
分析 n(Sn)=$\frac{11.9g}{119g/mol}$=0.1mol,n(HNO3)=12mol/L×0.1L=1.2mol,12mol/L的硝酸是浓硝酸,反应后溶液中c(H+)为8mol•L-1,说明生成的气体是二氧化氮,n(NO2)=$\frac{8.96L}{22.4L/mol}$=0.4mol,根据转移电子守恒确定生成物.
解答 解:n(Sn)=$\frac{11.9g}{119g/mol}$=0.1mol,n(HNO3)=12mol/L×0.1L=1.2mol,12mol/L的硝酸是浓硝酸,反应后溶液中c(H+)为8mol•L-1,说明生成的气体是二氧化氮,n(NO2)=$\frac{8.96L}{22.4L/mol}$=0.4mol,
设Sn被氧化后的化合价为x,根据转移电子守恒得
0.4mol×(5-4)=0.1mol×(x-0)
x=+4,
又溶液中c(H+)=8mol/L,而c(NO3-)=$\frac{1.2mol-0.4mol}{0.1L}$=8mol/L,根据溶液电中性可判断溶液中不存在Sn(NO3)4,
所以可能存在的是SnO2•4H2O,
故选C.
点评 本题考查氧化还原反应的计算,明确生成气体成分是解本题关键,再结合转移电子相等、电荷守恒分析解答,题目难度中等.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
18.进行化学实验必须注意安全,下列说法不正确的是( )
| A. | 点燃氢气前要检验纯度,以免发生爆炸 | |
| B. | 不慎将浓盐酸沾到皮肤上,要立即用浓碱溶液冲洗 | |
| C. | CO气体有毒,处理CO尾气的方法一般是将其点燃,转化成无毒的CO2 | |
| D. | 在盛O2的集气瓶中进行铁丝燃烧实验时,事先在集气瓶底铺上一层沙子 |
16.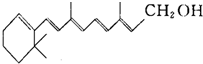 维生素A的结构简式如图所示,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来.关于它的叙述正确的是( )
维生素A的结构简式如图所示,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来.关于它的叙述正确的是( )
 维生素A的结构简式如图所示,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来.关于它的叙述正确的是( )
维生素A的结构简式如图所示,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来.关于它的叙述正确的是( )| A. | 维生素A的分子式为C20H28O | |
| B. | 维生素A是一种易溶于水的醇 | |
| C. | 维生素A能与酸发生酯化反应 | |
| D. | 1 mol维生素A在催化剂作用下最多可与7 mol H2发生加成反应 |
3.“司乐平”是治疗高血压的一种临床药物,其有效成分M的结构简式如图.下列关于M的说法正确的是( )
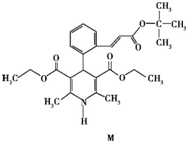

| A. | 属于芳香烃 | B. | 遇FeCl3溶液显紫色 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 1 mol M完全水解生成2 mol醇 |
13.钢铁制品经常进行烤蓝处理,即在铁制品的表面生成一层致密的Fe3O4.某学习小组为了研究烤蓝铁片,分别进行了以下实验操作:
(1)把一定量烤蓝铁片加工成均匀粉末.
(2)取m g该粉末,放入28.00mL 1mol/L的盐酸中,恰好完全反应,生成标准状况下的气体134.4mL,向溶液中滴入KSCN溶液,无明显现象.
(3)再取三份不同质量的粉末,分加加到相同体积(V)、物质的量浓度均为l0.00mol/L的三份硝酸溶液中,充分反应后,固体全部溶解,有关的实验数据如下表所示(假设NO是硝酸的唯一还原产物):
完成下列各题:
(1)实验(2)所得溶液中的溶质是FeCl2(写化学式).
(2)样品中n(Fe):n(Fe3O4)=4:1,m=0.912g.
(3)计算实验(3)中每份硝酸溶液的体积(V)(mL).
(4)若向实验Ⅱ所得溶液中继续加入铜粉,要使溶液中Cu2+、Fe2+、Fe3+同时存在,求加入铜粉的物质的量的范围.
(1)把一定量烤蓝铁片加工成均匀粉末.
(2)取m g该粉末,放入28.00mL 1mol/L的盐酸中,恰好完全反应,生成标准状况下的气体134.4mL,向溶液中滴入KSCN溶液,无明显现象.
(3)再取三份不同质量的粉末,分加加到相同体积(V)、物质的量浓度均为l0.00mol/L的三份硝酸溶液中,充分反应后,固体全部溶解,有关的实验数据如下表所示(假设NO是硝酸的唯一还原产物):
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入粉末质量/g | 13.68 | 27.36 | 34.20 |
| 生成气体的体积(标准状况)/L | 2.912 | 5.824 | 6.720 |
(1)实验(2)所得溶液中的溶质是FeCl2(写化学式).
(2)样品中n(Fe):n(Fe3O4)=4:1,m=0.912g.
(3)计算实验(3)中每份硝酸溶液的体积(V)(mL).
(4)若向实验Ⅱ所得溶液中继续加入铜粉,要使溶液中Cu2+、Fe2+、Fe3+同时存在,求加入铜粉的物质的量的范围.
20.下列排列顺序错误的是( )
| A. | 原子半径:O<S<Na | B. | 热稳定性:NH3<PH3<H2S | ||
| C. | 酸性:H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3<Mg(OH)2<NaOH |
18.通过溶解、过滤、蒸发等操作,可以将下列各组固体混合物分离的是( )
| A. | 硝酸钠 氢氧化钠 | B. | 氧化铜 二氧化锰 | ||
| C. | 氯化钾 碳酸钙 | D. | 硫酸铜 氢氧化钠 |