题目内容
17. 有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色粘稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色粘稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:(1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍,则A的摩尔质量为90g/mol
(2)将此9.0g A在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4g和13.2g,则A的分子式为C3H6O3
(3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L H2(标准状况),实验结论:A中所含有官能团羧基、羟基
(4)A的核磁共振氢谱如图:则A的结构简式
 .
.
分析 (1)相同条件下,气体的相对分子质量之比等于密度之比;
(2)浓硫酸吸收水,碱石灰可以吸收二氧化碳,计算有机物A、生成水及二氧化碳的物质的量,根据原子守恒确定分子中C、H原子数目数目,结合相对分子质量计算O原子数目,进而确定有机物的分子式;
(3)羧基可以和碳酸氢钠发生化学反应生成二氧化碳,-OH、-COOH和金属钠发生化学反应生成氢气,根据生成气体物质的量判断含有的官能团;
(4)根据核磁共振氢谱图看出有机物中有4个峰值,则含4种类型的等效氢原子,且氢原子的个数比是3:1:1:1,结合A的分子式、含有的官能团确定A的结构简式.
解答 解:(1)有机物质的密度是相同条件下H2的45倍,所以有机物质的摩尔质量=45g/mol×2=90g/mol,故答案为:90g/mol;
(2)9.0gA的物质的量=$\frac{9g}{90g/mol}$=0.1mol,浓硫酸增重5.4g,则n(H2O)=$\frac{5.4g}{18g/mol}$=0.3mol,所含有n(H)=0.6mol,碱石灰增重13.2g,则n(CO2)=$\frac{13.2g}{44g/mol}$=0.3mol,所以分子中N(C)=$\frac{0.3mol}{0.1mol}$=3\N(H)=$\frac{0.3mol×2}{0.1mol}$=6,故分子中N(O)=$\frac{90-12×3-6}{16}$=3,故A的分子式为:C3H6O3,
故答案为:C3H6O3;
(3)9.0gA的物质的量为0.1mol,A和碳酸氢钠反应说明A中含有羧基,生成2.24LCO2(标准状况),n(CO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,所以含有一个羧基;
醇羟基和羧基都可以和金属钠发生反应生成氢气,与足量金属钠反应则生成2.24LH2(标准状况),n(H2)=0.1mol,羧基或羟基与钠反应生成氢气时,羧基或羟基的物质的量与氢气的物质的量之比为2:1,A与钠反应时,A的物质的量与氢气的物质的量之比是1:1,则说明A中除了含有一个羧基外还含有一个羟基,
故答案为:-COOH、-OH;
(4)根据核磁共振氢谱图看出有机物中有4个峰值,则含4种类型的等效氢原子,氢原子的个数比是3:1:1:1,且A含有一个羧基、一个羟基,所以结构简式为: ,
,
故答案为: .
.
点评 本题考查有机物分子式与结构式的确定,掌握燃烧法利用原子守恒确定有机物分子式,注意根据A和碳酸氢钠、钠反应时生成气体体积判断含有的官能团,熟练掌握官能团的性质与转化,难度中等.

| A. | 密度 | B. | 原子数 | C. | 质量 | D. | 分子数 |
| A. | 氯气 | B. | 硫化氢 | C. | 三氧化硫 | D. | 二氧化碳 |
| A. | 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O═2SO32-+4Cl-+6H+ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═Fe3++2Fe2++4H2O | |
| C. | 加热可增强纯碱溶液去污力:CO32-+2H2O?H2CO3+2OH- | |
| D. | 过量CO2通入Ca(ClO)2溶液中:ClO-+CO2+H2O=HCO3-+HClO |
| A. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O | |
| C. | 用水可区分苯和溴苯 | |
| D. | 结构如图(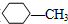 )的物质其一氯代物有4种 )的物质其一氯代物有4种 |
| A. |  实验室制甲烷 | B. |  实验室制乙炔 | ||
| C. |  石油的蒸馏 | D. |  实验室制乙烯 |
| A. | 往碳酸镁中滴加稀盐酸:CO32-+2H+═CO2↑+H2O | |
| B. | 将少量硅投入氢氧化钠溶液中:Si+2OH-+H2O═SiO32-+H2↑ | |
| C. | 淀粉碘化钾溶液在空气中变蓝:4I-+O2+2H2O═2 I2+4OH- | |
| D. | 氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2Cl- |
