��Ŀ����
һ�������£�ͨ�����з�Ӧ��ʵ��ȼú��������Ļ��գ�
2CO(g)+SO2(g)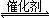 2CO2(g)+S(l) ��H
2CO2(g)+S(l) ��H
��1����֪2CO(g)+O2(g)= 2CO2(g) ��H1=��566kJ?mol��1
S(l) +O2(g)= SO2(g) ��H2=��296kJ?mol��1
��Ӧ�Ȧ�H= kJ?mol��1��
��2������������ͬ��������ͬʱ��SO2��ת�����淴Ӧ�¶ȵı仯��ͼa��260��ʱ ����Fe2O3��NiO��Cr2O3����������Ӧ������졣Fe2O3��NiO����������ʹSO2��ת���ʴﵽ��ߣ������Ǽ۸����أ�ѡ��Fe2O3����Ҫ�ŵ��� ��

��3������С����380�桢Fe2O3������ʱ���о��˲�ͬͶ�ϱ�[n(CO)��n(SO2)]��SO2ת���ʵ�Ӱ�죬�����ͼb�����ڴ������ͼ�л���n(CO)��n(SO2)="2��1" ʱ��SO2ת���ʵ�Ԥ�ڱ仯���ߡ�
��4����ҵ�ϻ�����Na2SO3��Һ���������е�SO2��Na2SO3+SO2+H2O=2NaHSO3��ij�¶�����1.0mol?L��1 Na2SO3��Һ���մ�����SO2������Һ��c(SO32��)����0.2mol?L��1ʱ���������������½���Ӧ�������ռ���
�ٴ�ʱ��Һ��c(HSO3��)ԼΪ______mol?L��1��
�ڴ�ʱ��ҺpH=______������֪���¶���SO32��+H+ HSO3����ƽ�ⳣ��K="8.0" �� 106 L?mol��1������ʱSO2��H2SO3��Ũ�Ⱥ��Բ��ƣ�
HSO3����ƽ�ⳣ��K="8.0" �� 106 L?mol��1������ʱSO2��H2SO3��Ũ�Ⱥ��Բ��ƣ�
2CO(g)+SO2(g)
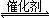 2CO2(g)+S(l) ��H
2CO2(g)+S(l) ��H��1����֪2CO(g)+O2(g)= 2CO2(g) ��H1=��566kJ?mol��1
S(l) +O2(g)= SO2(g) ��H2=��296kJ?mol��1
��Ӧ�Ȧ�H= kJ?mol��1��
��2������������ͬ��������ͬʱ��SO2��ת�����淴Ӧ�¶ȵı仯��ͼa��260��ʱ ����Fe2O3��NiO��Cr2O3����������Ӧ������졣Fe2O3��NiO����������ʹSO2��ת���ʴﵽ��ߣ������Ǽ۸����أ�ѡ��Fe2O3����Ҫ�ŵ��� ��

��3������С����380�桢Fe2O3������ʱ���о��˲�ͬͶ�ϱ�[n(CO)��n(SO2)]��SO2ת���ʵ�Ӱ�죬�����ͼb�����ڴ������ͼ�л���n(CO)��n(SO2)="2��1" ʱ��SO2ת���ʵ�Ԥ�ڱ仯���ߡ�
��4����ҵ�ϻ�����Na2SO3��Һ���������е�SO2��Na2SO3+SO2+H2O=2NaHSO3��ij�¶�����1.0mol?L��1 Na2SO3��Һ���մ�����SO2������Һ��c(SO32��)����0.2mol?L��1ʱ���������������½���Ӧ�������ռ���
�ٴ�ʱ��Һ��c(HSO3��)ԼΪ______mol?L��1��
�ڴ�ʱ��ҺpH=______������֪���¶���SO32��+H+
 HSO3����ƽ�ⳣ��K="8.0" �� 106 L?mol��1������ʱSO2��H2SO3��Ũ�Ⱥ��Բ��ƣ�
HSO3����ƽ�ⳣ��K="8.0" �� 106 L?mol��1������ʱSO2��H2SO3��Ũ�Ⱥ��Բ��ƣ���16�֣�
��1����270 ��3�֣�
��2��Cr2O3 ��3�֣� Fe2O3������ʱ������Խϵ��¶ȿɻ�ýϸ�SO2��ת���ʣ��Ӷ���Լ������Դ��3�֣�
��3������ͼ ��3�֣�

��4����1.6 ��2�֣� ��6 ��2�֣�
��1����270 ��3�֣�
��2��Cr2O3 ��3�֣� Fe2O3������ʱ������Խϵ��¶ȿɻ�ýϸ�SO2��ת���ʣ��Ӷ���Լ������Դ��3�֣�
��3������ͼ ��3�֣�

��4����1.6 ��2�֣� ��6 ��2�֣�
�����������1���۲��Ȼ�ѧ����ʽ֮��Ĺ�ϵ��������֪��1���Ȼ�ѧ����ʽ��ȥ��2���Ȼ�ѧ����ʽʱ���ܹ�ԼȥO2(g)�õ�2CO(g)+SO2(g)
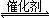 2CO2(g)+S(l)�����ݸ�˹���ɣ��÷�Ӧ�Ȧ�H=��H1����H2=��270kJ?mol��1����2����ͼa��֪��260��ʱƽ��ת���ʣ�Cr2O3> Fe2O3>NiO���ɴ��ƶ�Cr2O3������ʱ��Ӧ������죻��ͼ��֪��Fe2O3��NiO����������ʹSO2��ת���ʴﵽ��ߣ���SO2��ת������ͬʱ����Ӧ�¶ȣ�Fe2O3<NiO������Fe2O3������ʱ����Ҫ�ŵ�������Խϵ��¶ȿɻ�ýϸ�SO2��ת���ʣ��Ӷ���Լ������Դ����3����ͼb��֪������������ͬʱ������n(CO)��n(SO2)�ı�ֵ����������CO��Ӧ��Ũ�ȣ���������Ӧ���ʣ����̴ﵽƽ���ʱ�䣬��ʹƽ��������Ӧ��Ӧ�����ƶ���ʹSO2��ת������������ͼa��380��ʱSO2��ת������ߣ�����n(CO)��n(SO2)�ı�ֵΪ2��1��Ϊ3��1ʱ��SO2��ƽ��ת���ʻ�������ȫ��ͬ��ֻ�Ǵﵽƽ���ʱ�����̣��ɴ˿�����ͼb�л����й��¶ȶԷ�Ӧ���ʺ�ƽ���ƶ���Ӱ��ͼ��4�������⣬Na2SO3��NaHSO3����ǿ����ʣ������ƶϷ�Ӧ������������ʼŨ�ȡ��仯Ũ�ȡ������Լ�ʱŨ�ȣ���
2CO2(g)+S(l)�����ݸ�˹���ɣ��÷�Ӧ�Ȧ�H=��H1����H2=��270kJ?mol��1����2����ͼa��֪��260��ʱƽ��ת���ʣ�Cr2O3> Fe2O3>NiO���ɴ��ƶ�Cr2O3������ʱ��Ӧ������죻��ͼ��֪��Fe2O3��NiO����������ʹSO2��ת���ʴﵽ��ߣ���SO2��ת������ͬʱ����Ӧ�¶ȣ�Fe2O3<NiO������Fe2O3������ʱ����Ҫ�ŵ�������Խϵ��¶ȿɻ�ýϸ�SO2��ת���ʣ��Ӷ���Լ������Դ����3����ͼb��֪������������ͬʱ������n(CO)��n(SO2)�ı�ֵ����������CO��Ӧ��Ũ�ȣ���������Ӧ���ʣ����̴ﵽƽ���ʱ�䣬��ʹƽ��������Ӧ��Ӧ�����ƶ���ʹSO2��ת������������ͼa��380��ʱSO2��ת������ߣ�����n(CO)��n(SO2)�ı�ֵΪ2��1��Ϊ3��1ʱ��SO2��ƽ��ת���ʻ�������ȫ��ͬ��ֻ�Ǵﵽƽ���ʱ�����̣��ɴ˿�����ͼb�л����й��¶ȶԷ�Ӧ���ʺ�ƽ���ƶ���Ӱ��ͼ��4�������⣬Na2SO3��NaHSO3����ǿ����ʣ������ƶϷ�Ӧ������������ʼŨ�ȡ��仯Ũ�ȡ������Լ�ʱŨ�ȣ���SO32��+SO2+H2O=2HSO3��
��ʼŨ�ȣ�mol/L�� 1.0 0
�仯Ũ�ȣ�mol/L�� 0.8 1.6
�����Լ�ʱŨ�ȣ�mol/L�� 0.2 1.6
������Լ�ʱ��c(HSO3��)=1.6mol/L
����SO32��+H+
 HSO3����ƽ�ⳣ��K= c(HSO3��)/[ c(SO32��)? c(H+)]����c(H+)= c(HSO3��)/[ c(SO32��)?K)]������c(HSO3��)=1.6mol/L��c(SO32��)=0.2mol/L�����¶���K="8.0" �� 106 L?mol��1����c(H+)=1.6/(0.2��8.0 �� 106) mol/L=10��6 mol/L��������Һ��pH="��lg" c(H+)=������6��=6��
HSO3����ƽ�ⳣ��K= c(HSO3��)/[ c(SO32��)? c(H+)]����c(H+)= c(HSO3��)/[ c(SO32��)?K)]������c(HSO3��)=1.6mol/L��c(SO32��)=0.2mol/L�����¶���K="8.0" �� 106 L?mol��1����c(H+)=1.6/(0.2��8.0 �� 106) mol/L=10��6 mol/L��������Һ��pH="��lg" c(H+)=������6��=6��
��ϰ��ϵ�д�
 Сѧ��ʱ��ѵϵ�д�
Сѧ��ʱ��ѵϵ�д�
�����Ŀ
 CO(g) + 3H2(g) ��H =" +206.2" kJ/mol
CO(g) + 3H2(g) ��H =" +206.2" kJ/mol CO(NH2)2 (l) + H2O (l)���÷�Ӧ��ƽ�ⳣ�����¶ȹ�ϵ���£�
CO(NH2)2 (l) + H2O (l)���÷�Ӧ��ƽ�ⳣ�����¶ȹ�ϵ���£� ����ͼ�ǰ�̼�ȣ�x����CO2ƽ��ת���ʣ������Ĺ�ϵ����ͼ�е�B�㴦��NH3��ƽ��ת���ʡ�
����ͼ�ǰ�̼�ȣ�x����CO2ƽ��ת���ʣ������Ĺ�ϵ����ͼ�е�B�㴦��NH3��ƽ��ת���ʡ�





 2NH3(g)��H<0
2NH3(g)��H<0
 H2O(l) �Ħ�H ="+" 40��69 kJ��mol-1
H2O(l) �Ħ�H ="+" 40��69 kJ��mol-1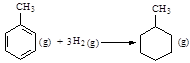 �Ħ�HΪ��384 kJ��mol-1
�Ħ�HΪ��384 kJ��mol-1 2Fe(s)+3CO2(g) ��H
2Fe(s)+3CO2(g) ��H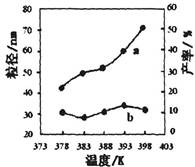
 CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g) C(s) =
C(s) =