题目内容
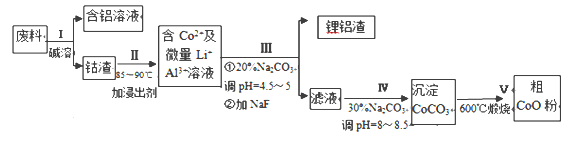
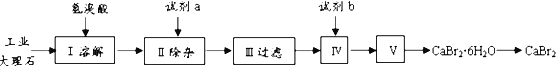
【题目】溴化钙具有易溶于水、易吸潮等性质。溴化钙可用作阻燃剂、制冷剂,实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
回答下列问题:
(1)已知步骤III的滤液中不含NH4+。步骤II加入的试剂a是___________,控制溶液的pH约为8.0的目的是___________、___________。
(2)试剂b是___________,步骤IV的目的是_______。
(3)步骤V所含的操作依次是________________、过滤。
(4)制得的溴化钙可以通过如下步骤测定其纯度:
称取4.00g无水溴化钙样品;溶解;滴入足量Na2CO3溶液,充分反应;过滤;烘干;冷却。若得到1.88g碳酸钙,则溴化钙的质量分数为_________。 若实验操作规范而测定结果偏低,其原因是_______________。
【答案】氢氧化钙 使铁离子、铝离子沉淀完全 防止氢氧化铝溶解 HBr 除去过量的氢氧化钙 蒸发浓缩,冷却结晶 94% CaBr2吸水
【解析】
(1)加入试剂a、控制溶液的pH约为8.0的目的是除去杂质Al3+、Fe3+,防止氢氧化铝溶解,因此a是碱,根据题意及不引入新的杂质可知是氢氧化钙;
(2)加试剂b的目的是除去过量的a,是氢溴酸;
(3)步骤Ⅴ的结果得到CaBr26H2O,因此其操作步骤为蒸发浓缩,冷却结晶、过滤;
(4)根据CaBr2~CaCO3可求CaBr2的质量,进而计算质量分数;溴化钙易吸水,因此造成测定结果偏低。
(1)加入试剂a,控制溶液的pH约为8.0的目的是除去杂质Al3+、Fe3+,防止氢氧化铝溶解, a是碱,根据题意及不引入新的杂质可知是氢氧化钙;
(2)加试剂b的目的是除去过量的氢氧化钙,且不引入新杂质,b应是氢溴酸;
(3)步骤Ⅴ的结果从溶液中得到CaBr26H2O,因此其操作步骤为蒸发浓缩,冷却结晶、过滤;
(4)CaBr2~CaCO3
200 100
3.76g 1.88g
CaBr2的质量为3.76g,质量分数为=![]() ×100%=94%;溴化钙易吸水,因此造成测定结果偏低。
×100%=94%;溴化钙易吸水,因此造成测定结果偏低。

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案